题目内容
1.100mL浓度为2mol•L-1的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )| A. | 加入适量的18.4mol/L的硫酸 | B. | 加入几滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的硫酸钠溶液 |
分析 增大反应物浓度、升高温度、增大压强(仅限于有气体参与的化学反应)、加入催化剂等加快反应速率,但不影响生成氢气的总量,说明最终酸电离出的氢离子物质的量不变.
解答 解:A.浓硫酸与锌反应不生成氢气,故A错误;
B.氯化铜和锌反应生成Cu,Cu、Zn和稀硫酸构成原电池,加快反应速率,硫酸电离出氢离子的物质的量不变,所以生成氢气的总量不变,故B正确;
C.加水稀释导致氢离子浓度减小,反应速率降低,故C错误;
D.加入适量的硫酸钠溶液,体积增大,氢离子浓度降低,反应速率减小,故D错误.
故选B.
点评 本题考查化学反应速率影响因素,外界条件只影响反应速率但物质性质决定反应速率,知道反应速率的影响有哪些,题目难度不大.

练习册系列答案
相关题目
11.下列关于反应热的说法正确的是( )
| A. | 可逆反应“CO(g)+H2O(g)═CO2(g)+H2(g)”中的△H小于0,说明此反应为吸热反应 | |
| B. | 已知S(s)+O2(g)═SO3(g)的反应热为△H═-385.5kJ•mol-1,说明硫的燃烧热为385.5 kJ•mol-1 | |
| C. | 一个化学反应的反应热等于反应物的总能量减去生成物的总能量 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
12.下列说法正确的是( )
| A. | 向Na2SO4溶液中加入过量BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42- | |
| B. | Ksp小的物质的溶解能力一定比Ksp大的物质的小 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 洗涤沉淀时,洗涤次数越多越好 |
9.在四个不同的容器中,采用不同条件进行合成氨反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是( )
| A. | 用H2表示的反应速率为0.1 mol/(L•min) | |
| B. | 用NH3表示的反应速率为0.3 mol/(L•min) | |
| C. | 用N2表示的反应速率为0.2mol/(L•min) | |
| D. | 用H2表示的反应速率为0.3 mol/(L•min) |
16.下列物质中属于酯类的是( )
| A. | 石蜡油 | B. | 甘油 | C. | 酚醛树脂 | D. | 花生油 |
6.下列有关物质归纳的说法中,正确的一组是( )
①蔗糖和麦芽糖互为同分异构体
②塑料、橡胶和纤维素都是合成高分子材料
③植物油、直馏汽油都可与溴水发生加成反应
④糖类、油脂、蛋白质都能发生水解反应
⑤分馏、干馏、裂化都是化学变化.
①蔗糖和麦芽糖互为同分异构体
②塑料、橡胶和纤维素都是合成高分子材料
③植物油、直馏汽油都可与溴水发生加成反应
④糖类、油脂、蛋白质都能发生水解反应
⑤分馏、干馏、裂化都是化学变化.
| A. | ①③⑤ | B. | 只有① | C. | ②④ | D. | ②⑤ |
10.等质量的CH4和NH3相比较,下列结论错误的是( )
| A. | 二者的分子个数之比为17:16 | B. | 二者的原子个数之比为17:16 | ||
| C. | 二者的氢原子个数之比为17:12 | D. | 在相同条件下二者体积比为17:16 |
11.下列物质中,属于氧化物的是( )
| A. | MgO | B. | H2SO4 | C. | NaOH | D. | CaCO3 |
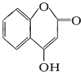 是用来制备抗凝血药的医药中间体,可通过下列路线合成:
是用来制备抗凝血药的医药中间体,可通过下列路线合成: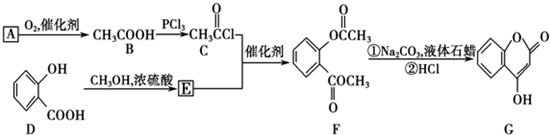
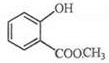 .
.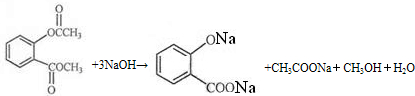 .
.