��Ŀ����
����Ŀ���ɶ�����Ԫ����ɵ�����֮���ת����ϵ����ͼ��ʾ�����У�AΪ����Ԫ����ɵĻ������Ӧ��������C��D���ʵ���֮��Ϊ3��4��D�Dz�����ˮ�İ�ɫ���壬����Ӧ�ۢ���������Ӧ������Һ�н��У�F��G����̬�ǽ������ʣ�K��һ�ֳ����ķǼ����л��ܼ����ܶȱ�ˮ��ijЩ������ͷ�Ӧ��������ȥ��
��1����Ӧ�۵�����Ϊ��
��2��A�Ļ�ѧʽ����K�ĵ���ʽ��
��3��д���ٷ�Ӧ�Ļ�ѧ����ʽ����
��4�����F��Ԫ����Ԫ�����ڱ��е�λ������
��5��E�н��������ӵļ��鷽����
��6��д����Ӧ�ߵ����ӷ���ʽ����
��7�������ӷ���ʽ��ʾH��Һ�Լ��Ե�ԭ�� ��
���𰸡�
��1��ȡ����Ӧ
��2��Al4C3��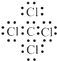
��3��Al4C3+12H2O�T4Al��OH��3+3CH4��
��4���������ڢ�A��
��5��ȡE����Һ������ɫ��Ӧ����������ɫΪ��ɫ����֤����Na+
��6��Al3++AlO2��+6H2O�T4Al��OH��3��
��7��AlO2��+2H2O?Al��OH��3+OH��
���������⣺KΪ�л��Ǽ����ܼ����ܶȴ���ˮ���ж�KΪCCl4 �� ��C�����嵥��F���ɣ��ж�FΪCl2 �� ��CΪCH4 �� ���߷���ȡ����Ӧ����CCl4��F��B��Һ������ɣ�ͬʱ���ɷǽ������嵥��G���ж�GΪH2 �� ������Ԫ�ؾ�Ϊ������Ԫ�أ��ж�BΪNaCl���ɴ˵�EΪNaOH�������䷴Ӧ�İ�ɫ������ˮ�Ĺ��壬�������ڢٷ�Ӧ���ٷ�Ӧ��AΪ����Ԫ����ɣ���ˮ��Ӧ������CH4 �� ��A�к���CԪ�أ����뵽CaC2��ˮ�ķ�Ӧ��ȷ��AΪ����̼�����������C��D�ı�����ȷ��AΪAl4C3 �� ��DΪAl��OH��3 �� ��E��NaOH����Ӧ���ɵ�HΪNaAlO2 �� G��F����IΪHCl��H��I��HCl����Ӧ����JΪAlCl3 �� J��H��Ӧ��Al3+��AlO2�����ӷ���˫ˮ������Al��OH��3�ķ�Ӧ����1����Ӧ���Ǽ�������������ȡ����Ӧ�������Ȼ�̼�����Դ��ǣ�ȡ����Ӧ����2��A��ѧʽ��Al4C3��K��CCl4 �� ����ʽΪ 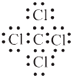 �����Դ��ǣ�Al4C3��
�����Դ��ǣ�Al4C3�� 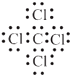 ��3���ٷ�Ӧ�Ļ�ѧ����ʽ��Al4C3+12H2O�T4Al��OH��3+3CH4�������Դ��ǣ�Al4C3+12H2O�T4Al��OH��3+3CH4������4�����F��Ԫ��ΪCl����Ԫ�����ڱ��е�λ���ǣ��������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻��5��E��NaOH�����������ӵļ��鷽����ȡE����Һ������ɫ��Ӧ����������ɫΪ��ɫ����֤����Na+ �� ���Դ��ǣ�ȡE����Һ������ɫ��Ӧ����������ɫΪ��ɫ����֤����Na+����6����Ӧ�ߵ����ӷ���ʽ��Al3++AlO2��+6H2O�T4Al��OH��3�������Դ��ǣ�Al3++AlO2��+6H2O�T4Al��OH��3������7�������ӷ���ʽ��ʾH��NaAlO2����Һ�Լ��Ե�ԭ��AlO2��+2H2OAl��OH��3+OH�� �� ���Դ��ǣ�AlO2��+2H2OAl��OH��3+OH�� ��
��3���ٷ�Ӧ�Ļ�ѧ����ʽ��Al4C3+12H2O�T4Al��OH��3+3CH4�������Դ��ǣ�Al4C3+12H2O�T4Al��OH��3+3CH4������4�����F��Ԫ��ΪCl����Ԫ�����ڱ��е�λ���ǣ��������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻��5��E��NaOH�����������ӵļ��鷽����ȡE����Һ������ɫ��Ӧ����������ɫΪ��ɫ����֤����Na+ �� ���Դ��ǣ�ȡE����Һ������ɫ��Ӧ����������ɫΪ��ɫ����֤����Na+����6����Ӧ�ߵ����ӷ���ʽ��Al3++AlO2��+6H2O�T4Al��OH��3�������Դ��ǣ�Al3++AlO2��+6H2O�T4Al��OH��3������7�������ӷ���ʽ��ʾH��NaAlO2����Һ�Լ��Ե�ԭ��AlO2��+2H2OAl��OH��3+OH�� �� ���Դ��ǣ�AlO2��+2H2OAl��OH��3+OH�� ��
