题目内容
2.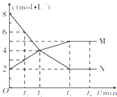 100℃时,密闭容器内某反应中各物质的物质的量浓度随反应时间变化的曲线如图所示,下列有关说法中正确的是( )
100℃时,密闭容器内某反应中各物质的物质的量浓度随反应时间变化的曲线如图所示,下列有关说法中正确的是( )| A. | t2时刻,v(M)=v(N) | |
| B. | t3~t4时段内平均反应速率为0 | |
| C. | 该反应可表示为2N?M | |
| D. | 若反应在80℃时进行,则t1时c(N)<6mol•L-1 |
分析 达到平衡时,N的物质的量浓度为2mol/L,变化量为8-2=6mol/L,M的物质的量浓度为5mol/L,变化量为5-2=3mol/L,反应的方程式为2N?M,结合图象解答该题.
解答 解:A、t2时刻,M和N的浓度相等,但变化量分别为4-2=2mol/L,8-4=4mol/L,所以反应速率不等,故A错误;
B、t3~t4时段答平衡,平均反应速率不变,但不为0,故B错误;
C、达到平衡时,N的物质的量浓度为2mol/L,变化量为8-2=6mol/L,M的物质的量浓度为5mol/L,变化量为5-2=3mol/L,反应的方程式为2N?M,故C正确;
D、若反应在80℃时进行,温度降低,反应速率降低,则t1时c(N)>6mol•L-1,故D错误;
故选:C.
点评 本题考查化学反应速率与化学平衡知识,做题时注意从反应物和生成物的物质的量的变化角度,判断反应物和生成物以及反应是否达到平衡,难度中等.

练习册系列答案
相关题目
3.将m1 g的氢氧化钠和碳酸氢钠的固体混合物在300℃条件下充分加热,排出分解产生的气体,得到固体的质量为m2 g,设$\frac{{m}_{2}}{{m}_{1}}$=a,下列有关说法正确的是( )
| A. | a的取值范围是$\frac{53}{84}$<a<$\frac{53}{62}$ | |
| B. | a=$\frac{53}{65}$,固体成分为碳酸钠和氢氧化钠 | |
| C. | a=$\frac{53}{75}$时,固体成分为碳酸钠 | |
| D. | 加热过程中产生二氧化碳的物质的量总是小于水的物质的量 |
4.等质量的镁和铝分别跟足量盐酸反应,生成的氢气的分子数之比为( )
| A. | 1:1 | B. | 3:4 | C. | 3:2 | D. | 8:9 |
10.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:查询资料,得有关物质的数据如下表: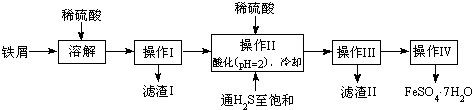
(1)检验制得的绿矾晶体中是否含有Fe3+,可以选用的试剂为AD.
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
④若定容时,视线高于液面,所测得的FeSO4•7H2O的质量分数偏高.(填“偏高”、“偏低”、“无影响”

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
④若定容时,视线高于液面,所测得的FeSO4•7H2O的质量分数偏高.(填“偏高”、“偏低”、“无影响”
17.按要求填空:
(1)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
①向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2═HCN+NaHCO3.
②不能证明HCN是弱电解质的方法是D
A.测得0.1mol/L HCN的pH>l
B.测得NaCN溶液的pH>7
C.0.1mol/L的HCN溶液与盐酸,稀释100倍后,HCN的pH大
D.用足量锌分别与相同浓度、相同体积的盐酸和HCN溶液反应,产生的氢气一样多
③25℃在CH3COOH与CH3COONa的溶液中,pH=6,则溶液中c(CH3COO-)/c(CH3COOH)=18.
(2)常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
①若c (HA)=c (NaOH)=0.lmol/L,测得混合后溶液的pH>7.原因是(用离子方程式表示)A-+H2O?HA+OH-.
②若在100℃时,pH (HA)+(NaOH)=12,测得混合后溶液的显中性pH=6.当c(HA)=0.02mol/L,c(NaOH)═0.04mol/L时,将两种溶液等体积混合后,溶液中由水电离出的H+浓度为10-10mol/L,混合后溶液的pH=10(假设混合后溶液体积为两溶液体积之和).
(1)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②不能证明HCN是弱电解质的方法是D
A.测得0.1mol/L HCN的pH>l
B.测得NaCN溶液的pH>7
C.0.1mol/L的HCN溶液与盐酸,稀释100倍后,HCN的pH大
D.用足量锌分别与相同浓度、相同体积的盐酸和HCN溶液反应,产生的氢气一样多
③25℃在CH3COOH与CH3COONa的溶液中,pH=6,则溶液中c(CH3COO-)/c(CH3COOH)=18.
(2)常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
①若c (HA)=c (NaOH)=0.lmol/L,测得混合后溶液的pH>7.原因是(用离子方程式表示)A-+H2O?HA+OH-.
②若在100℃时,pH (HA)+(NaOH)=12,测得混合后溶液的显中性pH=6.当c(HA)=0.02mol/L,c(NaOH)═0.04mol/L时,将两种溶液等体积混合后,溶液中由水电离出的H+浓度为10-10mol/L,混合后溶液的pH=10(假设混合后溶液体积为两溶液体积之和).
7.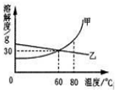 下表列出了固体物质A在不同温度时的溶解度:
下表列出了固体物质A在不同温度时的溶解度:
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为3:10(填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线应是图中的乙(填“甲”或“乙”);
(3)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出?不确定(填“有”、“没有”或“不确定”).
 下表列出了固体物质A在不同温度时的溶解度:
下表列出了固体物质A在不同温度时的溶解度:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 |
(2)通过对上表数据的分析,物质A的溶解度曲线应是图中的乙(填“甲”或“乙”);
(3)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出?不确定(填“有”、“没有”或“不确定”).
14.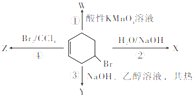 如图表示4-溴环己烯所发生的4个不同反应生成有机产物X、Y、Z、W,下列相关说法中不正确的是 ( )
如图表示4-溴环己烯所发生的4个不同反应生成有机产物X、Y、Z、W,下列相关说法中不正确的是 ( )
 如图表示4-溴环己烯所发生的4个不同反应生成有机产物X、Y、Z、W,下列相关说法中不正确的是 ( )
如图表示4-溴环己烯所发生的4个不同反应生成有机产物X、Y、Z、W,下列相关说法中不正确的是 ( )| A. | ①是氧化反应 | B. | Y、Z中均只含有一种官能团 | ||
| C. | Y是烃类丙可能有两种结构 | D. | X能与灼热的CuO反应生成醛类物质 |
11.下列各组离子能在指定溶液中,大量共存的是( )
| A. | 能使pH试纸呈红色的溶液中:NH4+,Al3+,I-,NO3- | |
| B. | 加入Al能放出H2的溶液中:Cl-,HCO3-,NO3-,NH4+ | |
| C. | pH=1的澄清透明溶液中:Cu2+,NH4+,K+,SO42- | |
| D. | FeCl3溶液中:SCN-,Na+,AlO2-,K+ |