题目内容
【题目】某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。

请填写下列空白:
(1)电解饱和食盐水的离子方程式 。若用石墨作电极电解500 mL饱和食盐水,当两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)时,所得溶液的pH为 (假设反应前后溶液体积不变)。
(2)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(3)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填字母编号)
A.向正反应方向进行 B.向逆反应方向进行 C.处于平衡状态
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2 t。
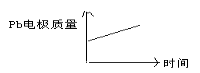
(4)用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜(含铁、锌等杂质,如图),在接通电路一段时间后纯Cu质量增加6.4 g。

请写出电解精炼过程中杂质参加的一个电极反应: 。
②燃料电池正极消耗氧气的体积是 (标准状况)。
(5)氢气是合成氨气的重要原料。
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -908 kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
【答案】⑴2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑(不写条件扣1分)13
2OH-+H2↑+Cl2↑(不写条件扣1分)13
(2)2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO
(3)①向逆反应方向进行②1.0
(4)①Zn-2e-=Zn2+(或者Fe-2e-=Fe2+)(1分)②1.12L
(5)4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808kJ·mol-1(完全正确得分)
【解析】
试题分析:(1)电解饱和食盐水的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。若用石墨作电极电解500 mL饱和食盐水,当两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)时,物质的量是1.12L÷22.4L/mol=0.05mol,其中氢气和氯气均是0.025mol,因此生成的氢氧化钠是0.05mol,浓度是0.05mol÷0.5L=0.1mol/L,所以所得溶液的pH为13。
2OH-+H2↑+Cl2↑。若用石墨作电极电解500 mL饱和食盐水,当两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)时,物质的量是1.12L÷22.4L/mol=0.05mol,其中氢气和氯气均是0.025mol,因此生成的氢氧化钠是0.05mol,浓度是0.05mol÷0.5L=0.1mol/L,所以所得溶液的pH为13。
(2)根据流程图判断:反应物FeTiO3、C、Cl2,得到的产物是FeCl3、TiCl4、CO,则钛铁矿经氯化得到四氯化钛的化学方程式为:2FeTiO3+ 6C+7Cl2=2FeCl3+2TiCl4+6CO;
(3)①该反应在 300 ℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为 2 L的密闭容器中,Qc=1/(1×1.5×1.5)=0.44>K,此时反应将向逆反应方向进行;
②由方程式CO(g)+2H2(g)![]() CH3OH(g)、2FeTiO3+6C+7Cl2
CH3OH(g)、2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO、2NaCl+2H2O
2FeCl3+2TiCl4+6CO、2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑得如下关系式:6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产19.2t甲醇,至少需额外补充1.0t氢气;
2NaOH+H2↑+Cl2↑得如下关系式:6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产19.2t甲醇,至少需额外补充1.0t氢气;
(4)①电解精炼过程中杂质参加的一个电极反应为Zn-2e-=Zn2+(或者Fe-2e-=Fe2+);
②电解精炼粗铜时,阴极电极反应为:Cu2++2e-=Cu,当生成6.4g纯铜,至少转移电子0.2mol,燃料电池的正极反应为:3O2+12e-+6H2O=12OH-,转移电子0.2mol,消耗氧气0.05mol,在标准状况下的体积为1.12L。
(5)已知:①4NH3(g)+5O2(g) =4NO(g)+6H2O(g) △H= -908 kJ·mol-l
②N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-l
则根据盖斯定律可知①-②×5即得到氨气被一氧化氮氧化生成氮气和气态水的热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1808kJ·mol-1。

 名校课堂系列答案
名校课堂系列答案