题目内容
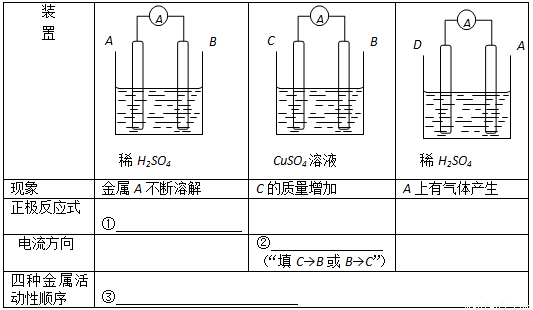
(6分) 由A、B、C、D四种金属按下表中装置进行实验,根据实验现象回答①②③
【答案】
(6分) 2H+ +2e-- == H2↑;C→B;D>A>B>C
【解析】
试题分析:金属A不断溶解,说明A是负极,失去电子,发生氧化反应,则A的金属性强于B的。其中正极是氢离子放电生成氢气,电极反应式是2H+ +2e-- == H2↑;C的质量增加,这说明C是正极,溶液中的铜离子放电,生成铜而形成,则电流方向是C→B,其中B的金属性强于C的;A和D构成原电池时,A上有气体产生,说明A是正极,溶液中的氢离子放电生成氢气,所以D的金属性强于A的。综上所述,四种金属的金属性强弱顺序是D>A>B>C。
考点:考查原电池的有关判断和应用
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。

练习册系列答案
相关题目