题目内容
将1 mol A2和1 mol B2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2A2(g)+B2(g)  2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量( )
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量( )
| A.等于0.3 mol |
| B.等于0.15 mol |
| C.小于0.15 mol |
| D.大于0.15 mol,小于0.3 mol |
C
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是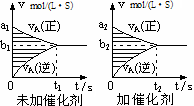
| A.b1>b2,t1>t2 |
| B.两图中阴影部分面积一定相等 |
| C.A的平衡转化率(II)大于(Ⅰ)中A的转化率 |
| D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g)△H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g)△H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
| A.从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min) |
| B.从20分钟到25分钟达到新的平衡,可能是增大压强 |
| C.其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小 |
| D.从开始到25分钟,CO2的转化率是70% |
在密闭的容器中进行如下反应:H2(g)+I2(g)  2HI(g),在温度T1和T2时,产物的量和时间的关系如图所示,根据图像判断正确的是 ( )
2HI(g),在温度T1和T2时,产物的量和时间的关系如图所示,根据图像判断正确的是 ( )
| A.T1<T2,ΔH<0 | B.T1>T2,ΔH<0 | C.T1<T2,ΔH>0 | D.T1>T2,ΔH>0 |
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为( )。
| A.v(NH3)=0.01 mol·L-1·s-1 | B.v(O2)=0.001 mol·L-1·s-1 |
| C.v(NO)=0.001 mol·L-1·s-1 | D.v(H2O)=0.045 mol·L-1·s-1 |
在一定温度时,将1mol A和2mol B放入容积为5 L的某密闭容器中发生如下反应:A(s)+2B(g) C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是( )
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是( )
| A.在5min内该反应用C的浓度变化表示的反应速率为 0.02mol·(L·min)-1 |
| B.在5min时,容器内D的浓度为0.2mol·L-1 |
| C.该可逆反应随反应的进行,容器内压强逐渐增大 |
| D.5min时容器内气体总的物质的量为3mol |
 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中正确的是 ( )。
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中正确的是 ( )。 ,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是 ( )
,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是 ( ) mol·(L·min)-1
mol·(L·min)-1