题目内容
【题目】将3.2gCu与足量的浓硫酸在加热条件下充分反应。
(1)请写出反应的方程式_________________;
(2)若把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的BaCl2溶液,得到沉淀2.33g,则稀释后所得溶液中SO42-的物质的量浓度为_______________。
(3)若把反应后的溶液稀释至500mL,加入铁粉。最多能溶解__________g铁粉
(4)把产生的气体缓缓通入100mLamol/L的NaOH溶液中,若反应物均无剩余,则a的取值范围是___________________。
(5)若浓疏酸中含溶质bmol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的n(H2SO4)_______0.5bmol(填“>”、“<”或“=”)
【答案】 Cu+2H2SO4(浓)![]() CuSO4+SO2+2H2O 0.2mol/L 5.6 0.5≤a≤1 <
CuSO4+SO2+2H2O 0.2mol/L 5.6 0.5≤a≤1 <
【解析】试题分析:(1)铜与浓硫酸反应的而化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2+2H2O。(2)得到沉淀2.33g是Ba SO4,BaSO4物质的量为:2.33g÷233g/mol=0.01mol,SO42-的物质的量浓度为:0.01mol/0.05L=0.2 mol/L。(3) 3.2gCu的物质的量为3.2g÷64g/mol=0.05mol,则溶液中Cu2+的物质的量为0.05mol,反应后溶液稀释至500mL,溶液中SO42-的总物质的量为:0.2 mol/L×0.5L=0.1mol,SO42-的物质的量大于Cu2+,根据溶液中阴阳离子所带的电荷数相同,则溶液中还有H+,H+的物质的量为:0.05×2+n(H+) ×1=0.1×2,得n(H+)=0.1mol,根据Fe + Cu2+═Fe2++Cu 、2H++ Fe═Fe2++H2↑,0.05mol的Cu2+,和0.1mol的H+完全反应消耗Fe的物质的量为0.1mol,质量为5.6g。(4)产生的气体是SO2,根据反应方程式3.2gCu完全反应可以生成0.05mol的SO2,SO2通入到NaOH溶液中发生可能的反应有 :SO2+2NaOH═Na2SO3+H2O、SO2+NaOH═NaHSO3,故NaOH的物质的量范围是:0.05mol≤n(NaOH)≤ 0.1mol,NaOH溶液的体积范围是:0.5L ≤a ≤ 1L。(5)由于随着反应的进行,浓硫酸的浓度逐渐变稀,成为稀硫酸后不能再与铜反应,故实际反应的铜要小于b mol,故还原的硫酸的物质的量n(H2SO4) ﹤0.5b mol
CuSO4+SO2+2H2O。(2)得到沉淀2.33g是Ba SO4,BaSO4物质的量为:2.33g÷233g/mol=0.01mol,SO42-的物质的量浓度为:0.01mol/0.05L=0.2 mol/L。(3) 3.2gCu的物质的量为3.2g÷64g/mol=0.05mol,则溶液中Cu2+的物质的量为0.05mol,反应后溶液稀释至500mL,溶液中SO42-的总物质的量为:0.2 mol/L×0.5L=0.1mol,SO42-的物质的量大于Cu2+,根据溶液中阴阳离子所带的电荷数相同,则溶液中还有H+,H+的物质的量为:0.05×2+n(H+) ×1=0.1×2,得n(H+)=0.1mol,根据Fe + Cu2+═Fe2++Cu 、2H++ Fe═Fe2++H2↑,0.05mol的Cu2+,和0.1mol的H+完全反应消耗Fe的物质的量为0.1mol,质量为5.6g。(4)产生的气体是SO2,根据反应方程式3.2gCu完全反应可以生成0.05mol的SO2,SO2通入到NaOH溶液中发生可能的反应有 :SO2+2NaOH═Na2SO3+H2O、SO2+NaOH═NaHSO3,故NaOH的物质的量范围是:0.05mol≤n(NaOH)≤ 0.1mol,NaOH溶液的体积范围是:0.5L ≤a ≤ 1L。(5)由于随着反应的进行,浓硫酸的浓度逐渐变稀,成为稀硫酸后不能再与铜反应,故实际反应的铜要小于b mol,故还原的硫酸的物质的量n(H2SO4) ﹤0.5b mol

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
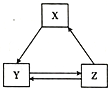
选项 | X | Y | Z |
A | NH3 | NO2 | HNO3 |
B | SiO2 | Na2SiO3 | H2SiO3 |
C | Al2O3 | NaAlO2 | Al(OH)3 |
D | CO2 | Na2CO3 | NaHCO3 |
A. A B. B C. C D. D