题目内容
(1)试用化学方程式表示该反应(不用配平)
(2)该反应的氧化剂是
(3)当有1mol Cl2参加反应时,转移的电子数为
(2)得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(3)根据氯气和转移电子之间的关系式计算.
故答案为:Cl2+Na2SO3+H2O→HCl+Na2SO4;
(2)通过(1)知,氯气是氧化剂,亚硫酸钠是还原剂,故答案为:氯气;亚硫酸钠;
(3)1mol氯气参加氧化还原反应生成2molHCl,转移电子数=2[0-(-1)]mol×NA/mol=2NA,故答案为:2NA.

(一)、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
|
浓度/mol.L |
4x10ˉ6 |
6x 10ˉ6 |
2x10ˉ5 |
4x10ˉ5 |
3x10ˉ5 |
2x10ˉ5 |
根据表中数据判断PM2.5为 , (填“酸性”、“中性”或“碱性”)
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)
 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
 H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(二)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式______
(2)下列各项中,能说明元素C比E非金属性强的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
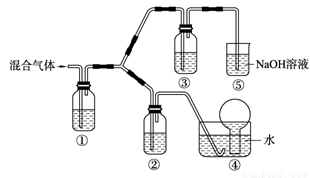
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2=NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应装置②、③中盛放的药品依次是______、______。
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。

 等,其主要是利用了H2O2的作用是_____________________________________________ (填“氧化性”或“还原性”).
等,其主要是利用了H2O2的作用是_____________________________________________ (填“氧化性”或“还原性”). 氯水;
氯水;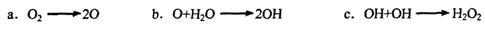
 等,其主要是利用了 H2O2的作用是_____________________________________________
(填“氧化性”或“还原性”).
等,其主要是利用了 H2O2的作用是_____________________________________________
(填“氧化性”或“还原性”).