题目内容
【题目】(15分)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表).回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为 .
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1).第二周期部分元素的E1变化趋势如图(a)所示, 
其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是 .
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示.
①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为 . (填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5﹣中的σ键总数为个.分子中的大π键可用符号Πmn表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则N5﹣中的大π键应表示为 .
③图(b)中虚线代表氢键,其表示式为(NH4+)N﹣H…Cl、、 .
(4)R的晶体密度为dgcm﹣3 , 其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为 .
【答案】
(1)![]()
(2)同周期从左到右核电荷数依次增大,半径逐渐减小,故结合一个电子释放出的能量依次增大;N的2p能级处于半充满状态,相对稳定,不易结合电子
(3)ABD;C;5NA;Π56;(H3O+)O﹣H…N;(NH4+)N﹣H…N
(4)![]()
【解析】解:(1)氮原子价层电子为最外层电子,即2s22p3 , 则电子排布图为 ![]() ,故答案为:
,故答案为: ![]() ;(2)元素的非金属性越强,越易得到电子,则第一电子亲和能越大,同周期从左到右核电荷数依次增大,半径逐渐减小,从左到右易结合电子,放出的能量增大,N的最外层为半充满结构,较为稳定,不易结合一个电子,
;(2)元素的非金属性越强,越易得到电子,则第一电子亲和能越大,同周期从左到右核电荷数依次增大,半径逐渐减小,从左到右易结合电子,放出的能量增大,N的最外层为半充满结构,较为稳定,不易结合一个电子,
故答案为:同周期从左到右核电荷数依次增大,半径逐渐减小,故结合一个电子释放出的能量依次增大;N的2p能级处于半充满状态,相对稳定,不易结合电子;(3)①A.阳离子为H3O+和NH4+ , NH4+中心原子N含有4个σ键,孤电子对数为 ![]() =0,价层电子对数为4,杂化类型为sp3 , H3O+中心原子是O,含有3σ键,孤电子对数为
=0,价层电子对数为4,杂化类型为sp3 , H3O+中心原子是O,含有3σ键,孤电子对数为 ![]() =1,价层电子对数为4,为sp3杂化;
=1,价层电子对数为4,为sp3杂化;
B.由以上分析可知H3O+和NH4+中心原子的价层电子对数都为4;
C.NH4+为空间构型为正四面体,H3O+为空间构型为三角锥形;
D.含有的共价键类型都为σ键.
两种阳离子的相同之处为ABD,不同之处为C;
故答案为:ABD;C;
②根据图(b)N5﹣中键总数为5NA个,根据信息,N5﹣有6个电子可形成大π键,可用符号Π56表示,
故答案为:5NA;Π56;
③O、N的非金属性较强,对应的O﹣H、N﹣H都可与H形成氢键,还可表示为(H3O+)O﹣H…N、(NH4+)N﹣H…N,
故答案为:(H3O+)O﹣H…N、(NH4+)N﹣H…N;(4)由d= ![]() =
= 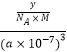 可知,y=
可知,y= ![]() ,故答案为:
,故答案为: ![]() .
.
(1)氮原子价层电子为最外层电子,即2s22p3 , 书写电子排布图;(2)同周期从左到右核电荷数依次增大,半径逐渐减小,从左到右易结合电子,放出的能量增大,N的最外层为半充满结构,较为稳定;(3)①根据图(b),阳离子为H3O+和NH4+ , NH4+中心原子N含有4个σ键,孤电子对数为 ![]() =0,价层电子对数为2,杂化类型为sp3 , H3O+中心原子是O,含有3σ键,孤电子对数为
=0,价层电子对数为2,杂化类型为sp3 , H3O+中心原子是O,含有3σ键,孤电子对数为 ![]() =1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形;②根据图(b)N5﹣中键总数为5NA个,根据信息,N5﹣的大π键可用符号Π56;③O、N的非金属性较强,对应的O﹣H、N﹣H都可与H形成氢键;(4)根据d=
=1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形;②根据图(b)N5﹣中键总数为5NA个,根据信息,N5﹣的大π键可用符号Π56;③O、N的非金属性较强,对应的O﹣H、N﹣H都可与H形成氢键;(4)根据d= ![]() =
= 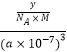 计算.
计算.

 名校课堂系列答案
名校课堂系列答案【题目】某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
①连接好仪器,检验装置的气密性;
②正确添加试剂;
③点燃C装置中的酒精灯;
④向圆底烧瓶中滴加10%过氧化氢溶液;
⑤点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热.
根据以上所有内容回答下列问题:
(1)装置e的作用是;
(2)写出d中发生反应的化学方程式;
(3)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出'化学反应方程式;
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如表):
实验变量 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的实验目的是 .
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为 min.(填范围)
(5)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有
(填物质名称),要除去该物质,可先在混合液中加入(填写下列选项中的字母),然
后再通过(填操作名称)即可除去.
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4 .
【题目】下列图中的实验方案,能达到实验目的是( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A.A
B.B
C.C
D.D
【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2 . 
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:
(2)气流从左至右,装置接口连接顺序是a
(3)装置C中干燥管中所盛试剂的名称是: , 作用是:
(4)装置D中发生的化学方程式是:
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验: 称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00molL﹣1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl﹣)滴定结果如表所示:
滴定次数 | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 1.04 | 25.03 |
2 | 1.98 | 25.99 |
3 | 3.20 | 25.24 |
①写出滴定过程中所发生的2个离子方程式 ,
②样品中氯化亚铁的质量分数为 .





