题目内容
在实验室中用二氧化锰跟盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: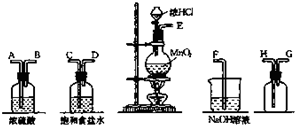
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接
(2)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:
②尾气吸收装置中进行的反应:
(3)将足量氯气溶于水制成的饱和氯水,由于
(4)下列化学反应,在实验室中也可用来制取氯气.请分析后填写下列空格:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
用15.8g KMnO4氧化足量的上述浓盐酸,则有
分析:(1)气体的制备一般经过气体的发生装置、净化、除杂、干燥装置、收集装置,尾气处理装置,据此解答;
(2)①气体发生装置中的二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰、水;
②氯气有毒用氢氧化钠溶液吸收,氢氧化钠和氯气反应生成氯化钠、次氯酸钠、水;
(3)饱和氯水中存在Cl2+H2O?H++Cl-+HClO,所含分子只有Cl2和H2O、HClO分子,所含的离子只有H+、Cl-、ClO-和OH-,结合对应微粒的性质解答该题;
(4)依据方程式可知16mol氯化氢中只有10mol氯化氢中的氯化合价升高,做还原剂,被氧化,6mol氯化氢中氯元素化合价不变表现出酸性,依据化学方程式计算参加反应的HCl的物质的量和生成的氯气的体积,然后求出被还原的盐酸的物质的量.
(2)①气体发生装置中的二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰、水;
②氯气有毒用氢氧化钠溶液吸收,氢氧化钠和氯气反应生成氯化钠、次氯酸钠、水;
(3)饱和氯水中存在Cl2+H2O?H++Cl-+HClO,所含分子只有Cl2和H2O、HClO分子,所含的离子只有H+、Cl-、ClO-和OH-,结合对应微粒的性质解答该题;
(4)依据方程式可知16mol氯化氢中只有10mol氯化氢中的氯化合价升高,做还原剂,被氧化,6mol氯化氢中氯元素化合价不变表现出酸性,依据化学方程式计算参加反应的HCl的物质的量和生成的氯气的体积,然后求出被还原的盐酸的物质的量.
解答:解:(1)要得到干燥纯净的氯气,实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气,即实验装置为E-C,D-A,B-H,G-F,
故答案为:CDABHG;
(2)①二氧化锰和浓盐酸反应的化学方程式为:MnO2+4HCl(浓
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓
MnCl2+Cl2↑+2H2O;
②尾气吸收装置中氯气与氢氧化钠的反应方程式:2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
(3)将足量氯气溶于水,氯气和水发生反应,化学方程式为Cl2+H2O?HCl+HClO,由于次氯酸具有不稳定性见光易分解,因此需保存在棕色瓶中;
氯水含有盐酸和次氯酸,溶液呈酸性,存在大量的H+,则pH<7,向pH试纸上滴加新制氯水,溶液呈酸性,则先变红,但由于次氯酸具有漂白性,则最终试纸褪色,
故答案为:次氯酸;棕色;先变红后褪色;H+、HClO;
(4)设15.8gKMnO4能与nmolHCl发生反应,生成标准状况下VLCl2.
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2×158 g 16mol 5×22.4 L
15.8g n V
则:n=
=0.8(mol),
V=
=5.6L,
依据方程式可知在氯化氢反应中既表现还原性又表现酸性,表现还原性的盐酸占总量的
,
所以被氧化的氯化氢的物质的量为:0.8mol×
=0.5mol,
即15.8g KMnO4氧化足量的上述浓盐酸,则有0.5mol盐酸被氧化.产生的Cl2在标准状况下的体积为5.6L,
故答案为:0.5;5.6.
故答案为:CDABHG;
(2)①二氧化锰和浓盐酸反应的化学方程式为:MnO2+4HCl(浓
| ||
| ||
②尾气吸收装置中氯气与氢氧化钠的反应方程式:2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
(3)将足量氯气溶于水,氯气和水发生反应,化学方程式为Cl2+H2O?HCl+HClO,由于次氯酸具有不稳定性见光易分解,因此需保存在棕色瓶中;
氯水含有盐酸和次氯酸,溶液呈酸性,存在大量的H+,则pH<7,向pH试纸上滴加新制氯水,溶液呈酸性,则先变红,但由于次氯酸具有漂白性,则最终试纸褪色,
故答案为:次氯酸;棕色;先变红后褪色;H+、HClO;
(4)设15.8gKMnO4能与nmolHCl发生反应,生成标准状况下VLCl2.
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2×158 g 16mol 5×22.4 L
15.8g n V
则:n=
| 16×15.8 |
| 2×158 |
V=
| 5×22.4×15.8 |
| 2×158 |
依据方程式可知在氯化氢反应中既表现还原性又表现酸性,表现还原性的盐酸占总量的
| 10 |
| 16 |
所以被氧化的氯化氢的物质的量为:0.8mol×
| 10 |
| 16 |
即15.8g KMnO4氧化足量的上述浓盐酸,则有0.5mol盐酸被氧化.产生的Cl2在标准状况下的体积为5.6L,
故答案为:0.5;5.6.
点评:本题考查氯气的实验室制备和化学方程式的有关计算,题目难度中等,注意高锰酸钾与浓盐酸反应中盐酸表现的性质.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目


 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
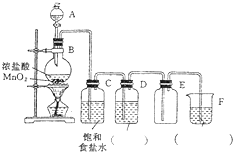 在实验室中用二氧化锰和浓盐酸反应制备干燥的氯气,装置图如图:
在实验室中用二氧化锰和浓盐酸反应制备干燥的氯气,装置图如图: