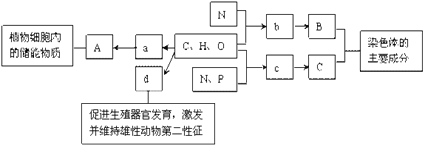
题目内容
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol1
C. 密闭容器中,0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol1
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= —38.6kJ·mol1
2NH3(g) △H= —38.6kJ·mol1
【答案】C
【解析】A. 中和反应是放热反应,△H<0,A错误;B. 在一定条件下,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量是燃烧热,因此不能根据2C(s)+O2(g)=2CO(g)△H=-221 kJ·mol-1得出C的燃烧热,B错误;C. 密闭容器中0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量,则生成1molFeS时放出的热量是![]() ,因此热化学方程式为Fe(s)+S(s)=FeS(s)△H=-95.6 kJ·mol1,C正确;D. 合成氨反应是可逆的,根据已知信息不能计算该反应的反应热,D错误,答案选C。
,因此热化学方程式为Fe(s)+S(s)=FeS(s)△H=-95.6 kJ·mol1,C正确;D. 合成氨反应是可逆的,根据已知信息不能计算该反应的反应热,D错误,答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目