题目内容
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置来制取乙酸乙酯。试回答下列问题:

(1)写出由CH3COOH与C2H518OH制取乙酸乙酯的化学反应方程式__________。
(2)该反应需加入一定量的浓硫酸,则浓硫酸的主要作用是_______________。
(3)右边试管内所盛饱和碳酸钠溶液的主要作用是_______。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止___。
(5)若要把制得的乙酸乙酯分离出来,主要使用的玻璃仪器是_________。(答仪器的名称)
【答案】 CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O 催化作用,吸水作用 中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯 倒吸 分液漏斗
CH3CO18OCH2CH3+H2O 催化作用,吸水作用 中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯 倒吸 分液漏斗
【解析】(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O;(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂;(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;(4)乙醇和乙酸均与水互溶,导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;(5)乙酸乙酯不溶于水,若要把制得的乙酸乙酯分离出来需要分液,主要使用的玻璃仪器是分液漏斗。
CH3CO18OCH2CH3+H2O;(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂;(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;(4)乙醇和乙酸均与水互溶,导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;(5)乙酸乙酯不溶于水,若要把制得的乙酸乙酯分离出来需要分液,主要使用的玻璃仪器是分液漏斗。

【题目】阿司匹林(主要成分为乙酰水杨酸)是解热止痛、治疗感冒的药物。它是由水杨酸(邻羟基苯甲酸)与醋酸酐进行酯化反应制得的。其反应原理如下:
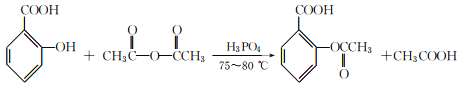
为避免醋酸酐水解,所用原料、仪器要充分干燥。有关物质的参数如下表:
名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
水 | 乙醇 | 乙酸乙酯 | |||||
水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | -73.1 | 138.6 | 易溶 | 溶 | 易溶 |
乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |
制取阿司匹林的工艺流程如下:
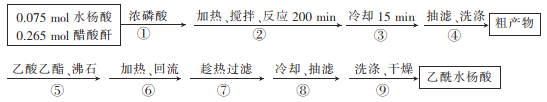
回答下列问题:
(1)浓磷酸的作用是__________。步骤②的加热方式为水浴加热,温度控制在________℃。
(2)向粗产物中加入乙酸乙酯的作用是_________________。
(3)验证最后得到的乙酰水杨酸产品较为纯净的方法是_________________
(4)精制后乙酰水杨酸的质量为8.91 g,则其产率为______,造成产率低的原因可能有__________(任写一点)。
【题目】钨主要用于制造硬质或耐高温的合金。自然界中黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。黑钨矿冶炼钨的工艺流程如下:
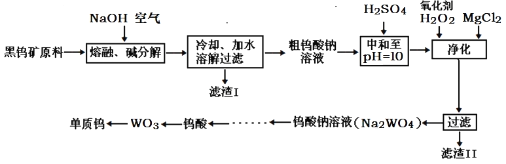
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为__________,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是__________,滤渣Ⅱ的主要成分是__________。
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表。
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成分 | WO3 W2O5 WO2 W |
已知:温度过高时,WO2(s)可转变为WO2(g)。
WO2(s)+2H2(g) ![]() W(s)+2H2O(g) △H =+66.0 kJ·mol-1
W(s)+2H2O(g) △H =+66.0 kJ·mol-1
WO2(s) ![]() WO2(g) △H =+203.9 kJ·mol-1
WO2(g) △H =+203.9 kJ·mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为_____________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小。不同温度下两种物质的沉淀溶解平衡曲线如右图,则T1时Ksp(CaWO4) =________。
在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为________。
(5)利用电解法可以从碳化钨(WC)废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为____________。

