题目内容
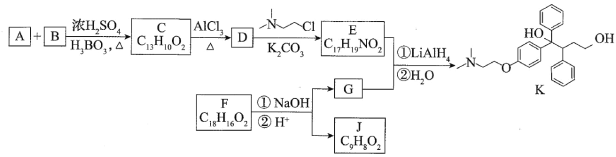
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是__________________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。
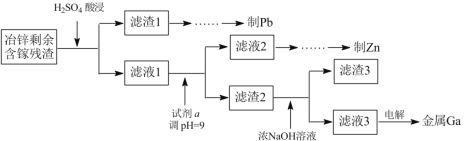
①试剂 a 是_______________。
②写出电解制镓时的阴极电极反应式__________________。
【答案】第三周期第ⅢA族 c Ga与As同周期,电子层数相同,核电荷数:As>Ga,原子半径:As<Ga,得电子能力:As>Ga,元素的非金属性:As>Ga,因此GaAs中As显负价,As与N同主族,最外层电子数为5,所以As为-3价 GaAs+11HNO3=Ga(NO3)3+8NO2↑+ H3AsO4+4H2O ZnO [Ga(OH)4]- +3e-=Ga+4OH-
【解析】
(1)Al是13号元素,位于元素周期表的第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)①a.镓与铝是同主族元素,同主族元素从上到下金属性增强,故Ga的金属性强于Al,所以碱性:Ga (OH)3> Al (OH)3,能用元素周期律解释,a不满足题意;
b.As与Ga同周期,Ga与Al是同主族元素,则Ga位于第ⅢA族,As 与 N 同主族,则As位于第ⅤA族,同周期元素从左往右,非金属性增强,故非金属性:As>Ga,能用元素周期律解释,b不满足题意;
c.H3AsO4和H3AsO3都是As的含氧酸,二者的酸性不能用元素周期律解释,c满足题意;
故答案为:c;
②Ga与As同周期,电子层数相同,核电荷数:As>Ga,原子半径:As<Ga,得电子能力:As>Ga,元素的非金属性:As>Ga,因此GaAs中As显负价,As与N同主族,最外层电子数为5,所以As为-3价,故答案为:Ga与As同周期,电子层数相同,核电荷数:As>Ga,原子半径:As<Ga,得电子能力:As>Ga,元素的非金属性:As>Ga,因此GaAs中As显负价,As与N同主族,最外层电子数为5,所以As为-3价;
③由题意可知GaAs作还原剂,浓HNO3作氧化剂,氧化产物为H3AsO4,浓硝酸对应的还原产物为NO2,结合电子得失守恒、原子守恒可写出该反应的化学方程式为:GaAs+11HNO3=Ga(NO3)3+8NO2↑+ H3AsO4+4H2O,故答案为:GaAs+11HNO3=Ga(NO3)3+8NO2↑+ H3AsO4+4H2O;
(3)①为提高浸取率,“H2SO4酸浸”时H2SO4应过量,滤液1显酸性,试剂a能消耗H+,使pH增大,同时不引入新的杂质,可用ZnO,故答案为:ZnO;
②Ga在碱性溶液中以[Ga(OH)4]- 形式存在,电解制镓,则阴极为[Ga(OH)4]-得电子生成Ga,阴极电极反应为:[Ga(OH)4]- +3e-=Ga+4OH-,故答案为:[Ga(OH)4]- +3e-=Ga+4OH-。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是
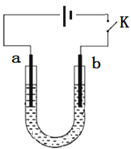
A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体