题目内容
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO△ 3Cu+N2+3H2O,对此反应的分析合理的是
| A.该反应属置换反应 |
| B.NH3被氧化为N2 |
| C.反应体现了金属铜的还原性 |
| D.每生成1mol H2O 就伴随着1mol电子转移 |
B
试题分析:A.单质与化合物反应产生新的单质和新的化合物的反应就置换反应。该反应的反应物无单质,所以不是置换反应。错误。B.在反应中NH3中的-3价的N变为N2中0价的N,化合价升高,失去电子,被氧化。正确。C.在反应中CuO中+2价的Cu变为单质Cu的0价,化合价降低,得到电子,被还原,氧化铜作氧化剂,体现了Cu的氧化性。错误。D.在反应2NH3+3CuO△ 3Cu+N2+3H2O中,每产生3mol的H2O,转移电子6mol,现在生成1mol的H2O,所以转移电子2mol.错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

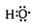 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同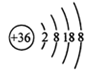

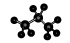
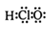
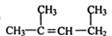 的名称为:1,3-二甲基-2-丁烯
的名称为:1,3-二甲基-2-丁烯 Na++HSO4-
Na++HSO4-