题目内容
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液。
其操作可分解为如下几步:
a. 移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b. 用标准盐酸溶液润洗滴定管2-3次
c. 把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d. 取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e. 调节液面至0或0刻度以下,记下读数
f. 把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)__________________ ____。
(2)滴定终点时溶液的颜色变化是 。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____ ___。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
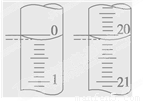
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为________ mL。
(5)某学生根据3次实验分别记录有关数据如下表:
|
滴定 次数 |
待测NaOH溶液的体积/mL |
0.1000mol/L盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.20 |
20.22 |
|
|
第二次 |
25.00 |
0.56 |
24.54 |
|
|
第三次 |
25.00 |
0.42 |
20.40 |
|
依据上表数据求得NaOH溶液的物质的量浓度为 。
(1)b d c e a f.(2)红色(或浅红色)变为无色,且半分钟内不恢复。(3)D (4)20.00 (5)0.0800mol/L
【解析】
试题分析:(1)用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液的实验步骤是b d c e a f. (2)用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,酚酞指示剂在NaOH溶液中。所以滴定终点时溶液的颜色变化是红色(或浅红色)变为无色,且半分钟内不恢复。(3)C(碱)={C (酸)·V(酸)}÷V(碱)。A.若酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,则滴加的标准酸溶液体积偏大,以此为标准计算的检验浓度偏大。错误。B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,这对于溶液的配制无任何影响。错误。C.若酸式滴定管在滴定前有气泡,滴定后气泡消失,则消耗的标准酸溶液的体积偏大,以此为标准计算的碱溶液浓度偏大。错误。D.读取盐酸体积时,开始仰视读数,读数偏大;滴定结束时俯视读数,读数偏小。最终消耗的标准酸溶液体积偏小,以此为标准计算的碱溶液的浓度偏小。正确。选项为D。(4)开始时液面读数为0.10ml,滴定终点时读数为20.10ml.所以消耗的酸标准溶液体积为20.00ml. (5)这三次消耗的酸溶液的体积分别是20.22-0.20=20.02; 24. 54-0.56=23.98; 20.40-0.42=19.98对这三次的实验数据进行分析,发现第二次偏差较大,去掉。V(HCl)= (20.02+19.98)÷2=20.00ml.C(NaOH)=( 0.1000mol/L×20.00ml) ÷25.00ml=0.0800mol/L.
考点:考查酸碱中和滴定的步骤、误差分析、终点的判断、读数物质的量浓度的计算等知识。

某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________,右手_____________________眼睛注视__________________________________直到因加入一滴盐酸后,溶液由黄色变______色,并且_____________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡 ,滴定后气泡消失
,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
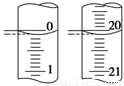
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL终点读数为_______mL,所用盐酸溶液的体积为_________mL
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积 | 0.1000mol/L盐酸的体积/mL[来源:学+科+网] | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ,直到最后加入一滴盐酸后,溶液由 色变为 ,且 为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为________ mL,
(4)某学生根据3次实验分别记录有关数据如下表:
|
滴定 次数 |
待测NaOH溶液的体积/mL |
0.100 mol/L盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.20 |
20.22 |
|
|
第二次 |
25.00 |
0.56 |
24.54 |
|
|
第三次 |
25.00 |
0.42 |
20.40 |
|
依据上表数据求得NaOH溶液的物质的量浓度为 。
某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是 。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
(3)某学生根据3次实验分别记录有关数据如下表:
|
滴定次数 |
待测NaOH 溶液的体积来 |
0.1000mol/L盐酸的体积/mL[来源:学+ |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.00 |
26.28 |
26.28 |
|
第二次 |
25.00 |
1.55 |
30.30 |
28.75 |
|
第三次 |
25.00 |
0.20 |
26.42 |
26.22 |
依据上表中有效数据计算该NaOH溶液的物质的量浓度:c(NaOH)=__________。(保留四位有效数字)
(4)用标准的盐酸滴定上述待测的NaOH溶液时,眼睛要注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液由黄色变________色,并且___________________为止。
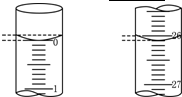 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: