��Ŀ����
��10�֣���ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��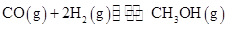 ��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯ͼ��
��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯ͼ��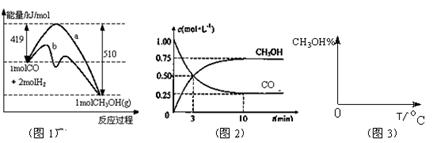
��ش��������⣺
��1���ڡ�ͼ1���У����� ����a��b����ʾʹ���˴������÷�Ӧ���� �������ȡ����ȣ���Ӧ��
��2������˵����ȷ����
| A����ʼ�����COΪ1molzxxk |
| B������COŨ�ȣ�CO��ת�������� |
| C��������ѹǿ�㶨ʱ����Ӧ�Ѵ�ƽ��״̬ |
| D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1molCO��2molH2���ٴδﵽƽ��ʱn(CH3OH)/n(CO)���С |
 CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ �������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ�� �����������С�����䡱����
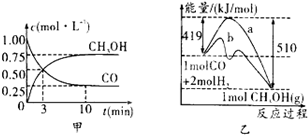
CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ �������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ�� �����������С�����䡱������4�����ڡ�ͼ3���л���ƽ��ʱ�״��ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2����P1<P2����
��5����֪CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(g) ����H����192.9kJ/mol
��֪H2O(l)= H2O(g) ��H����44 kJ/mol����д��32g��CH3OH(g)��ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ��
��1��b ���� ��2��C ��3��0.15mol��L-1��min-1 12 ��С
��4��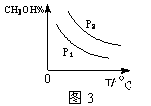
��5��CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(l) ��H����280.9kJ/mol
���������������1��ʹ�ô������ͷ�Ӧ��ܣ�����������b�������߿ɿ�����������������Ӧ�������ͣ���Ӧ���ȡ���2��A��CO��ʼŨ��Ϊ1mol/L���������2L����CO��ʼ��Ӧ��2mol��B������COŨ�ȣ���Ӧ��������ת���ʲ�һ������3�����ݷ�Ӧ���ʼ��㹫ʽ��V��H2��=C��H2��/��t=1.5mol/10min.L=0.15mol��L-1��min-1zai
ƽ�ⳣ�� ���������ݼ�����ġ��÷�Ӧ���ڷ��ȷ�Ӧ���������¶ȷ�Ӧ�����ƶ���ƽ�ⳣ����С����4����Ӧ�Ƿ��ȷ�Ӧ�����������¶�ƽ�������ƶ����״��ٷ������¶ȵ����߽��ͣ�����ͬ���¶ȡ�����£�ѹǿԽ��λ�����Ӧ��Ũ��Խ�ߣ�����Ӧ���ʼӿ죬ƽ�������ƶ����ʼ״��ٷ����ϸߣ�P2��P1֮��
���������ݼ�����ġ��÷�Ӧ���ڷ��ȷ�Ӧ���������¶ȷ�Ӧ�����ƶ���ƽ�ⳣ����С����4����Ӧ�Ƿ��ȷ�Ӧ�����������¶�ƽ�������ƶ����״��ٷ������¶ȵ����߽��ͣ�����ͬ���¶ȡ�����£�ѹǿԽ��λ�����Ӧ��Ũ��Խ�ߣ�����Ӧ���ʼӿ죬ƽ�������ƶ����ʼ״��ٷ����ϸߣ�P2��P1֮��
���㣺Ӱ�췴Ӧƽ������ء�ƽ�ⳣ���ļ��㡢��ѧ��Ӧ����
�������ۺϿ��黯ѧƽ���½ڵ����ݣ���ϤӰ�컯ѧ��Ӧ���ʼ���ѧƽ������ؼ���ԭ�����ڴ˻����Ͻ����Ƶ�


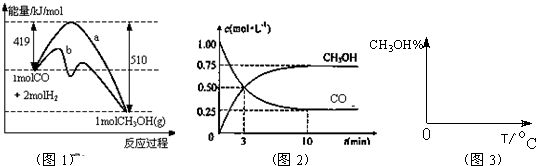
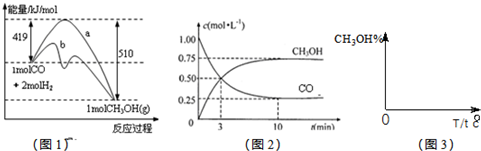
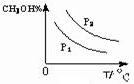
 ��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯��
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯��