题目内容
草酸晶体的组成可表示为H(1)实验中不需要的仪器是______________(填序号),还缺少的仪器有______________(填名称)。
a.托盘天平(带砝码、镊子) b.滴定管 c.100 mL量筒 d.100 mL容量瓶
e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中KMnO4溶液应装在_______________式滴定管中,因为_______________。
(3)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______________mol·L-1,由此可计算x的值为_______________。
(4)若滴定终点读数时目光俯视,则计算出的x值可能_______________(填偏大、偏小、无影响)。
解析:KMnO4与草酸发生氧化还原反应,根据电子守恒有
a×V×10-3×5=c酸×25×10-3×2
c酸=![]() mol·L-1
mol·L-1
n g草酸晶体中含H![]() ×0.1×90=0.9aV g
×0.1×90=0.9aV g
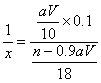
x=![]() -5
-5
答案:(1)cfj 胶头滴管
(2)酸 KMnO4有强氧化性,它能腐蚀橡胶,故不可以用碱式滴定管盛放
(3)![]() (
(![]() -5)
-5)
(4)偏大

练习册系列答案
相关题目
 +8H2O
+8H2O