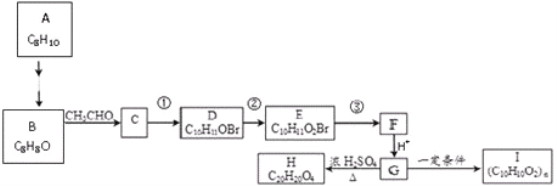
��Ŀ����
����Ŀ��̼����Ԫ���ǹ������������ҪԪ�أ��ڶ�ֲ���������������Ҫ���á�����Ҫ��ش��������⣺
��1������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����____________�����������ڻ�̬14Cԭ���У��������____________������״̬�෴�ĵ��ӡ�
��2����֪��(NH4)2CO3![]() 2NH3��+H2O��+CO2��
2NH3��+H2O��+CO2��
������ͬ���ڣ��ҵ�һ�����ܱ������Ԫ����____________�֡�
��(NH4)2CO3�ֽ����õ���̬��������ӵļ�����С�����˳��Ϊ____________���ѧʽ����
��3������ ��Cԭ���ӻ���ʽ��____________��
��Cԭ���ӻ���ʽ��____________��
��4�������[Cu(CH3C![]() N)4]BF4�У�ͭԭ�ӵļ۵��Ӳ�ʽΪ____________��BF4-�Ŀռ乹��Ϊ___________��д����BF4-��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ��___________��___________��
N)4]BF4�У�ͭԭ�ӵļ۵��Ӳ�ʽΪ____________��BF4-�Ŀռ乹��Ϊ___________��д����BF4-��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ��___________��___________��
��5��̼Ԫ���뵪Ԫ���γɵ�ij�־���ľ�����ͼ��ʾ��8��̼ԭ��λ��������Ķ��㣬4��̼ԭ��λ������������ģ�4����ԭ�����������ڣ����þ���Ӳ�ȳ������ʯ����Ϊ����һָ�ij�Ӳ�²��ϡ�
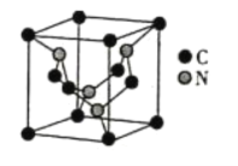
�پ�����Cԭ�ӵ���λ��Ϊ___________���þ���Ӳ�ȳ������ʯ��ԭ����___________��
����֪�þ����ı߳�Ϊapm�������ӵ�������NA��ʾ����þ�����ܶ�Ϊ___________g��cm-3��
���𰸡������� 2 3 H2O��NH3��CO2 sp2��sp3��sp 3d104s1 �������� CCl4 SO42- 4 �þ���ͽ��ʯ��Ϊԭ�Ӿ��壬�þ����е�C-N���ļ����Ƚ��ʯ�е�C-C���ļ����̣����ܴ�Ӳ�ȴ� ![]()
��������
��1������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ����õ�����������������̬14C�ĺ�������Ų���1s22s22p2��1s��2s�ϵ�������������״̬�෴��2p�ϵ�������������������ͬ���ʴ�Ϊ�������ƣ�2��
��2���ٵ�һ��������ָ��̬��̬������ԭ��ʧȥһ������ת��Ϊ��̬��̬������ʱ����Ҫ�������������ԭ�ӵĺ�������Ų��У�ԭ�ӹ��ȫ�ա��������ȫ����ʱ��Ϊ�ȶ����ڢ�A���N�����Ĺ��������� Ne�����Ĺ��ȫ������������ʧȥ�������ӣ�F��ԭ�Ӱ뾶С��O��ʧȥ������һ�����ӱ�O���ѡ��ʵڶ����ڵ�һ�����ܱ������Ԫ����N��F��Ne����3�֡�
��(NH4)2CO3�ֽ����õ���̬�������CO2Ϊֱ���ͽṹ������Ϊ180�㣬NH3��H2O������ԭ�Ӷ���sp3�ӻ���NH3����һ�Թµ��Ӷԣ�H2O �������Թµ��Ӷԣ����Լ���H2O��NH3��H2O��H��O��H�ļ���Ϊ104.5�㣬NH3��H��N��H�ļ���Ϊ107��18�@���������ַ��ӵļ�����С�����˳��ΪH2O��NH3��CO2��
��3�����е�̼ԭ�����Ե�������4��ԭ�ӣ�������������ṹ����sp3�ӻ��������ϵ�̼ԭ�ӹ�����ƽ��ṹ����sp2�ӻ��������̼ԭ�Ӻ͵�ԭ����������ϣ���sp�ӻ����������� ��Cԭ���ӻ���ʽ��sp2��sp3��sp��
��Cԭ���ӻ���ʽ��sp2��sp3��sp��
��4��ͭԭ�ӵļ۵��Ӳ�ʽΪ3d104s1��BF4-������ԭ��B�ļ۲���Ӷ���4�ԣ�Ϊsp3�ӻ���������ռ乹��Ϊ�������塣�ȵ�������ԭ��������ͬ���۵�������Ҳ��ͬ������������BF4-��Ϊ�ȵ��������CCl4��SO42-���ʴ�Ϊ��3d104s1���������壬CCl4��SO42-��
��5���پ�����ÿ��Cԭ�Ӻ�4����ԭ������������Cԭ�ӵ���λ��Ϊ4���þ���Ӳ�ȳ������ʯ��ԭ���Ǹþ���ͽ��ʯ��Ϊԭ�Ӿ��壬�þ����е�C-N���ļ����Ƚ��ʯ�е�C-C���ļ����̣����ܴ�Ӳ�ȴ�
����һ����������3��̼ԭ�Ӻ�4����ԭ�ӣ�����1������������Ϊ![]() g���þ����ı߳�Ϊapm����a��10-10cm������1�����������Ϊ��a��10-10��3=a3��10-30cm3��þ�����ܶ�Ϊ
g���þ����ı߳�Ϊapm����a��10-10cm������1�����������Ϊ��a��10-10��3=a3��10-30cm3��þ�����ܶ�Ϊ![]() g��cm-3��
g��cm-3��

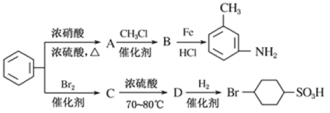
����Ŀ���±�Ϊ���ֶ����ڷǽ���Ԫ�ص����ʻ�ԭ�ӽṹ����֪A��D��ԭ��������������
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
A | Aԭ������������������������ԭ����������� |
B | ���������6�ֲ�ͬ�˶�״̬ |
C | ����⻯���ˮ��Һ�ʼ��� |
D | ��̬ԭ�ӵ�s�������������p��������� |
���ϱ�����Ϣ������и�С��(����ʱ������Ӧ��Ԫ�ط���)��
(1)д��Cԭ�ӵĵ����Ų�ͼ________��
(2)A��B��C��D�ĵ�һ�������ɴ�С��˳��Ϊ________��
(3)�õ��뷽��ʽ��ʾC������⻯���ˮ��Һ�ʼ��Ե�ԭ��________�����չ��ۼ����ۣ�������ÿ��ԭ�ӵ�������Ӳ���������ѱ��ͣ���֪ABCD���ӿ��������ֲ�ͬ�ṹ�����ǵĽṹ���Դ��������ʵĽṹ�л��������
(4)ABC�Ľṹʽ��______�������в���һ��Dԭ�ӣ����γ���λ��(������ʾ)��ABCD�ĽṹʽΪ_______��������C��ԭ�ӵ��ӻ�������______��������λ����ABCD�ĽṹʽΪ______������Dԭ�ӵ��ӻ�����Ϊ________��
(5)BD2�ĵ���ʽ��________��Dԭ�ӻ��ɵȵ��ӵ� ![]() ����ABCD�ĽṹʽΪ_______��������Cԭ�ӵ��ӻ�������_______��
����ABCD�ĽṹʽΪ_______��������Cԭ�ӵ��ӻ�������_______��
(6)��ABCD�����ֿ��ܽṹ��Bԭ�ӵ��ӻ�����________(������ͬ����������ͬ��)��
����Ŀ���±��г�������������Ԫ�������ڱ��е�λ�á�
�� | ��A | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
�밴Ҫ��ش��������⣺
��1������������Ԫ���зǽ�������ǿ����________����Ԫ�ط��ţ���
��2��Ԫ������ԭ�ӽṹʾ��ͼ��_________������������������Ԫ����ɵĻ���������ʽ��_________��
��3��Ԫ������������̬�⻯����ȶ��Խ�ǿ����________________���ѧʽ����Ԫ��������������������Ӧ��ˮ��������Խ�ǿ����________________���ѧʽ����
��4��������span>��������Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳����________________����Ԫ�ط��ţ���
��5��Ԫ����������ɵĻ�����Ļ�ѧ��������________________________��
��6��Ԫ����������������Ӧ��ˮ������Ԫ����������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ��________________
����Ŀ��ijѧϰС���о���Һ��Fe2+���ȶ��ԣ���������ʵ�飬�۲죬��¼�����

ʵ���
���� | 0 min | 1min | 1h | 5h |
FeSO4 | ����ɫ | �ۺ�ɫ | ��ɫ | ���ɫ |
(NH4)2Fe(SO4)2 | ������ɫ | ����ɫ | ��ɫ | �ۺ�ɫ |
��1������(NH4)2Fe(SO4)2��ҺpHС��FeSO4��ԭ����_______���û�ѧ�����ʾ������Һ���ȶ��ԣ�FeSO4_______(NH4)2Fe(SO4)2������������� ��
��2����ͬѧ���ʵ���������Һ���ȶ��Բ��������(NH4)2Fe(SO4)2��Һ�е�NH4+������Fe2+����ΪNH4+���л�ԭ�ԡ�����ʵ����˸ù۵㣬��ȫ��ʵ�顣
���� | ���� |
ȡ_______����_______���۲졣 | ��ʵ�����(NH4)2Fe(SO4)2��Һ������ͬ�� |
��3����ͬѧ���ʵ���������Һ���ȶ��Բ�������Һ���Բ�ͬ���£�����ʵ��ֱ�����0.80 mol��L��1 pHΪ1��2��3��4��FeSO4��Һ���۲죬����pH��1��FeSO4��Һ��ʱ�������Ա仯��pHԽ��FeSO4��Һ��Ƶ�ʱ��Խ�̡�
������ʾ����������Һ�д��ڷ�Ӧ 4Fe2+��O2��10H2O ![]() 4Fe(OH)3��8H+
4Fe(OH)3��8H+
��ʵ��III����ͬѧ�ɵó��Ľ�����_______��ԭ����_______��
��4����һ���о���ˮ��Һ��Fe2+�������������ⶨͬŨ��FeSO4��Һ�ڲ�ͬpH�����£�Fe2+������������ʱ��Ĺ�ϵ��ͼ��ʵ���������Һ�¶ȼ����ޱ仯������Ӧ���ڣ��������ʶ��������ԭ�������_____��

��5���ۺ�����ʵ�飬��ǿFe2+�ȶ��ԵĴ�ʩ��_______��