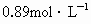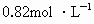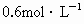题目内容
质量为8.02g的铁片,放进500mL0.80mol/L的CuSO4溶液中,过一段时间取出洗净、干燥后称量,质量变为8.66g.若认为溶液的体积没有变化,则溶液中Cu2+的浓度变为( )
| A.0.89mol/L | B.0.82mol/L | C.0.74mol/L | D.0.64mol/L |
设参加反应的Cu2+的物质的量为x,则
Fe+CuSO4═FeSO4+Cu△m
1 (64-56)g
x (8.66g-8.02g)
=
,解得x=0.08mol,
则溶液中Cu2+的浓度变为
=0.64mol/L,
故选D.
Fe+CuSO4═FeSO4+Cu△m
1 (64-56)g
x (8.66g-8.02g)
| 1 |
| x |
| (64-56)g |
| (8.66g-8.02g) |
则溶液中Cu2+的浓度变为
| 0.5L×0.8mol/L-0.08mol |
| 0.5L |
故选D.

练习册系列答案
相关题目
 的
的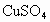 溶液中,过一段时间取出洗净、干燥后称重,变为8.66g,若认为溶液的体积没有变化,则剩余
溶液中,过一段时间取出洗净、干燥后称重,变为8.66g,若认为溶液的体积没有变化,则剩余 的浓度为
的浓度为