题目内容
15.NaH可用作生氢剂,反应的化学方程式是NaH+H2O═NaOH+H2↑.则下列说法正确的是( )| A. | NaOH是氧化产物 | B. | 该反应电子转移数为2e- | ||
| C. | NaH为还原剂 | D. | H2O既是还原剂又是氧化剂 |
分析 NaH+H2O═NaOH+H2↑中,NaH中H元素的化合价由-1价升高为0,H2O中H元素的化合价由+1价降低为0,以此解答.
解答 解:NaH+H2O═NaOH+H2↑中,NaH中H元素的化合价由-1价升高为0,H2O中H元素的化合价由+1价降低为0,
A.反应中只有H元素的化合价变化,则氢气既是还原产物又是氧产物,故A错误;
B.NaH+H2O═NaOH+H2↑中,NaH中H元素的化合价由-1价升高为0,H2O中H元素的化合价由+1价降低为0,则该反应转移电子数为1e-,故B错误;
C.在NaH中H元素的化合价由-1价升高为0,NaH为还原剂,故C正确;
D.NaH为还原剂,水为氧化剂,故D错误;
故选C.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意NaH中H为负价,题目难度不大.

练习册系列答案
相关题目
5. 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓度D (填字母).
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.
 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.
3.下列各项化学用语中表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | CH4分子的比例模型 | ||
| C. | 硫离子的结构示意图: | D. | 氮气的电子式 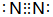 |
10.下列叙述正确的是( )
| A. | 乙烯和聚氯乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 乙烷、丙烷、丁烷都没有同分异构体 | |
| C. | 酒越陈越香与酯化反应有关 | |
| D. | 甲烷与足量氯气在光照下反应可生成难溶于水的油状液体 |
20.X、Y、Z、W为四种短周期元素,它们在周期表中的位置关系如图所示.Z元素的最外层电子数等于其电子层数.下列说法中正确的是( )
| X | |||
| Z | W | Y |
| A. | Y的气态氢化物比X的氢化物沸点低 | |
| B. | Z元素的氧化物属于碱性氧化物 | |
| C. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| D. | Y元素最高价氧化物对应的水化物化学式为H3YO4 |
7.有关化学用语正确的是( )
| A. | 乙烯的结构式C2H4 | B. | 正丁烷的结构简式CH3CH2CH2CH3 | ||
| C. | 四氯化碳的电子式 | D. | 苯的分子式 |
4.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
5.Q、W、X、Y、Z是原子序数依次增大的短周期元素,Q和Y均满足主族序数与周期序数相等,Q与X、W与Z同主族,Q和W能形成原子个数之比为1:1和2:1的常见无机化合物.下列说法不正确的是( )
| A. | 简单离子半径:Z>W>X>Y | |
| B. | W、X形成的化合物中一定含有离子键 | |
| C. | 最简单氢化物的还原性:Z>W | |
| D. | 工业上常用电解熔融氯化物的方法制备X、Y的单质 |
 .
.