题目内容
20.下列物质中属于非电解质,但通入或放入水中后所得溶液导电性明显增强的是( )| A. | 氯气 | B. | 三氧化硫 | C. | 氯化钠 | D. | 乙醇 |
分析 在水溶液和熔融状态下都不导电的化合物为非电解质;非电解质在溶液中能够导电,说明溶于水后发生反应生成了电解质,如二氧化硫、三氧化硫、氨气等,据此进行解答.
解答 解:A.氯气为单质,所以钠既不是电解质,也不是非电解质,故A错误;
B.三氧化硫为为非电解质,溶于水后生成硫酸,硫酸能够电离出氢离子和硫酸根离子,所以三氧化硫溶于水后能够导电,故B正确;
C.氯化钠在水溶液和熔融状态下能够导电的化合物,所以氯化钠为电解质,故C错误;
D.乙醇在水溶液和熔融状态下都不导电,乙醇为非电解质,但是乙醇溶于水也不导电,故D错误;故选B.
点评 本题考查了电解质与非电解质、溶液的导电性判断,题目难度不大,注意掌握电解质与非电解质的概念及判断方法,明确溶液能够导电的条件及影响因素.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
9.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 125g CuSO4•5H2O晶体中含有Cu2+离子数一定小于0.5NA | |
| B. | 常温下,pH=3的醋酸溶液中,醋酸分子的数目一定大于10-3NA | |
| C. | 由S6、S7、S8组成的硫蒸气6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 3.6g C与3.36L O2一定条件下恰好完全反应,生成CO分子数一定为0.3NA |
15.热化学方程式中的物质必须要注明聚集状态,原因是( )
| A. | 能描述出反应发生的状态 | B. | 说明反应条件 | ||
| C. | 为了区别一般的化学方程式 | D. | 物质呈现的状态与反应热有关 |
5.大气污染物NOx、SO2和可吸入颗粒物(PM2.5)等会危害人体健康,影响动植物生长因此应加强对其检测和治理.
(1)NOx可导致的环境问题有ab(选填编号).
a.酸雨 b.臭氧层受损
(2)为减少SO2的排放,可用于吸收SO2的物质是b(选填编号).
a.CaCl2溶液 b.Ca(OH)2溶液
(3)为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出.写出NO被CO还原的化学方程式:2XCO+2N0X$\frac{\underline{\;催化剂\;}}{\;}$2XCO2+N2.
(4)某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如表:
据此可判断试样中c(H+)=8×10-5mol/L.
(1)NOx可导致的环境问题有ab(选填编号).
a.酸雨 b.臭氧层受损
(2)为减少SO2的排放,可用于吸收SO2的物质是b(选填编号).
a.CaCl2溶液 b.Ca(OH)2溶液
(3)为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出.写出NO被CO还原的化学方程式:2XCO+2N0X$\frac{\underline{\;催化剂\;}}{\;}$2XCO2+N2.
(4)某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如表:
| 离子 | H+ | Na+ | NH4+ | NO3- | SO42- |
| 浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
12.下列说法正确的是( )
| A. | 乙烯和苯都能发生加成反应 | |
| B. | 乙醇和乙酸都能与氢氧化钠溶液反应 | |
| C. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| D. | 葡萄糖和蔗糖都可发生银镜反应 |
10.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图1甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称),所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图1甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图2所示.
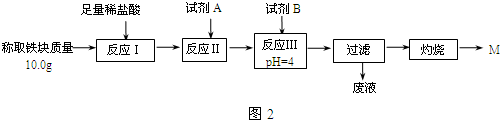
几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”),原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图1甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称),所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图1甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图2所示.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”),原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

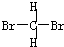 和
和 E.甲烷和庚烷F.
E.甲烷和庚烷F.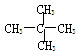 和C(CH)3
和C(CH)3 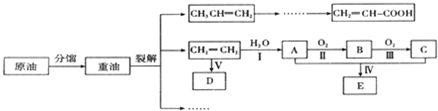
 .
.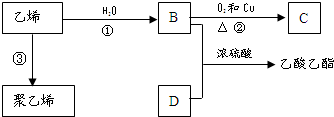 已知乙烯能发生如图转化
已知乙烯能发生如图转化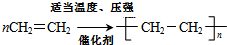 ,反应类型加聚反应.
,反应类型加聚反应.