题目内容
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
(1)下列有关酸雨的说法正确的是______(填序号).
A.SO2、NO2或CO2都会导致酸雨的形成
B.NO不溶于水,所以不会造成酸雨污染
C.燃煤时鼓入足量空气,可以减少酸雨的产生
D.采用清洁能源,可以减少酸雨的产生
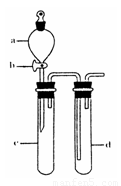
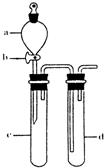
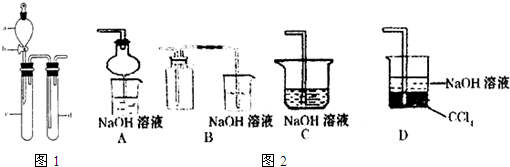
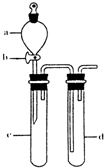
(2)某兴趣小组采用如图装置制取并探究SO2气体的性质.
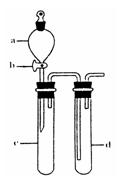
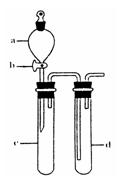
①下列实验方案适用于用右图所示装置制取所需SO2的是______(填序号).
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,______
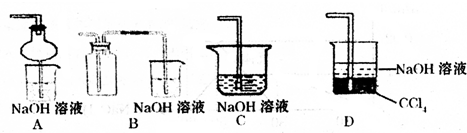
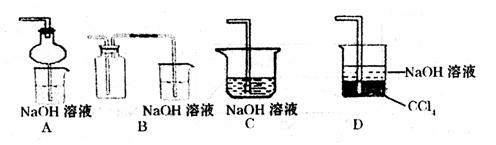
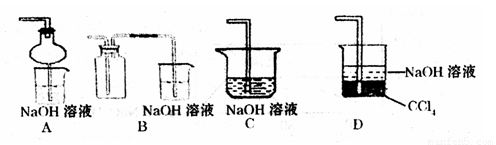
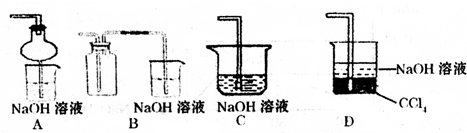
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是______(填序号).
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性.为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是______原因是______.
解:(1)A、SO2、NO2都会导致酸雨的形成,二氧化碳溶于水形成的是弱酸且水溶液中不稳定分解,不形成酸雨,CO2会形成温室效应,故A错误;
B、NO不溶于水,但会在放电时和氧气反应生成二氧化氮,溶于水生成硝酸,会造成酸雨污染,故B错误;
C、燃煤时鼓入足量空气,只能使燃料燃烧充分,不能减少二氧化硫的排放,不能减少酸雨的产生,故C错误;
D、采用清洁能源,减少二氧化硫等污染气体的排放,可以减少酸雨的产生,故D正确;
故选:D
(2)①该装置属于固液或液液混合不加热型装置,
A、Na2SO3溶液与HNO3反应时,硝酸会氧化亚硫酸钠本身被还原为一氧化氮,故A不符合;
B、Na2SO3固体与浓硫酸不加热反应,利用浓硫酸难挥发性可以反应生成二氧化硫气体,故B符合;
C.硫燃烧不需要分液漏斗,故C不符合;
D.铜和浓硫酸反应需要加热,故D不符合;
故选B;
②利用压强差检验装置的气密性,所以气密性检验的方法是:试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好,
故答案为:试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好;
③增加一尾气吸收装置防止污染性气体排放到空气中,装置需要很好地吸收气体,又能防止倒吸,BC易发生倒吸,AD可以吸收尾气,也可以防倒吸,故答案为:AD;
④亚铁离子和二氧化硫都具有还原性,所以都能使酸性高锰酸钾溶液褪色,无法确定到底是哪种微粒使酸性高锰酸钾溶液褪色,所以A不合理,
故答案为:A,因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成.
分析:(1)形成酸雨的主要成分是二氧化硫和氮氧化物;
(2)①该反应装置属于固液混合不加热型装置,根据反应物状态和反应条件分析;
②利用压强差检验装置的气密性;
③依据尾气成分选择吸收的试剂,装置中需要防止倒吸;
④二氧化硫和亚铁离子都能被酸性高锰酸钾氧化.
点评:本题考查较综合,涉及酸雨的形成、离子的检验、反应装置的选取等知识点,难度中等,明确尾气处理的原理.
B、NO不溶于水,但会在放电时和氧气反应生成二氧化氮,溶于水生成硝酸,会造成酸雨污染,故B错误;
C、燃煤时鼓入足量空气,只能使燃料燃烧充分,不能减少二氧化硫的排放,不能减少酸雨的产生,故C错误;
D、采用清洁能源,减少二氧化硫等污染气体的排放,可以减少酸雨的产生,故D正确;
故选:D
(2)①该装置属于固液或液液混合不加热型装置,
A、Na2SO3溶液与HNO3反应时,硝酸会氧化亚硫酸钠本身被还原为一氧化氮,故A不符合;
B、Na2SO3固体与浓硫酸不加热反应,利用浓硫酸难挥发性可以反应生成二氧化硫气体,故B符合;
C.硫燃烧不需要分液漏斗,故C不符合;
D.铜和浓硫酸反应需要加热,故D不符合;
故选B;
②利用压强差检验装置的气密性,所以气密性检验的方法是:试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好,
故答案为:试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好;
③增加一尾气吸收装置防止污染性气体排放到空气中,装置需要很好地吸收气体,又能防止倒吸,BC易发生倒吸,AD可以吸收尾气,也可以防倒吸,故答案为:AD;
④亚铁离子和二氧化硫都具有还原性,所以都能使酸性高锰酸钾溶液褪色,无法确定到底是哪种微粒使酸性高锰酸钾溶液褪色,所以A不合理,
故答案为:A,因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成.
分析:(1)形成酸雨的主要成分是二氧化硫和氮氧化物;
(2)①该反应装置属于固液混合不加热型装置,根据反应物状态和反应条件分析;
②利用压强差检验装置的气密性;
③依据尾气成分选择吸收的试剂,装置中需要防止倒吸;
④二氧化硫和亚铁离子都能被酸性高锰酸钾氧化.
点评:本题考查较综合,涉及酸雨的形成、离子的检验、反应装置的选取等知识点,难度中等,明确尾气处理的原理.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.