题目内容
7.某饱和一元醛发生银镜反应可得21.6g银;将等量的该醛完全燃烧,生成3.6g水.此醛可能是( )| A. | 甲醛 | B. | 乙醛 | C. | 丙醛 | D. | 丁醛 |
分析 若为甲醛,则HCHO~4Ag,根据Ag的质量可以计算甲醛物质的量,再根据H原子守恒计算生成水的物质的量,与实际生成水的物质的量进行比较判断;
若不是甲醛,饱和一元醛的通式是CnH2nO,根据关系式R-CHO~2Ag计算醛的物质的量,根据H原子守恒计算醛中H原子数目,再结合组成通式可以计算醛的分子式.
解答 解:21.6g Ag的物质的量为$\frac{21.6g}{108g/mol}$=0.2mol,醛燃烧生成水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,
若为甲醛,则HCHO~4Ag,可知HCHO的物质的量为$\frac{0.2mol}{4}$=0.05mol,根据H原子守恒可知,甲醛燃烧生成水为$\frac{0.05mol×2}{2}$=0.05mol≠0.2mol,故不可能为HCHO;
设饱和一元醛的通式是CnH2nO,由R-CHO~2Ag可知,醛的物质的量为0.2mol×$\frac{1}{2}$=0.1mol,由H原子守恒可知醛中H原子数目为$\frac{0.2mol×2}{0.1mol}$=4,则分子中碳原子数目为2,则该醛为CH3CHO,
故选:B.
点评 本题考查有机物分子式确定,涉及醛的银镜反应,解题关键抓住-CHO~2Ag关系确定醛的物质的量,注意甲醛与Ag的物质的量之比为1:4,难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
16.一定量的盐酸与过量的锌片反应时,为了减小反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A. | NaOH固体 | B. | CuCl2固体 | C. | NaCl固体 | D. | CH3COONa固体 |
17.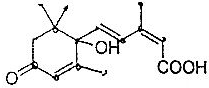 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、醛基、羧基 | |
| B. | 可以发生加成、加聚、取代、氧化等反应 | |
| C. | 含有2个手性碳原子 | |
| D. | S-诱抗素制剂的分子式为C15H20O4 |
14.下列有关物质的分类正确的是( )
| 酸性氧化物 | 一元酸 | 强电解质 | 分散系 | |
| A | Mn2O7 | 丙酸 | 三氧化二铝 | 黄河水 |
| B | NO2 | 高氯酸 | 盐酸 | 有色玻璃 |
| C | SiO2 | 石炭酸 | 氢氧化铝 | 云、雾 |
| D | SO2 | 硝酸 | 溴化氢 | 冰水混合物 |
| A. | A | B. | B | C. | C | D. | D |
2.用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下:

已知:①一定条件下,MnO4 -可与Mn2+反应生成MnO2
②部分金属阳离子生成氢氧化物沉淀的pH如下表:
③常温下,Fe(OH)3:Ksp=1.1×10-36,Fe(OH)2:Ksp=1.64×10-14,Al(OH)3:Ksp=1.3×10-33
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)检验滤液中存在Fe3+的方法是取少量滤液于试管,滴加KSCN溶液,溶液变为红色,则滤液中有Fe3+(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.7;
(Ⅱ)加热,产生大量红褐色沉淀,静置,上层溶液呈紫红色;
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的:将Fe2+氧化为Fe3+;调节溶液的pH为3.7的目的是调节pH值使铁元素沉淀完全,此时溶液中c(Fe3+)为1.1×10-5.1mol•L-1
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成有黄绿色气体,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)

已知:①一定条件下,MnO4 -可与Mn2+反应生成MnO2
②部分金属阳离子生成氢氧化物沉淀的pH如下表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.7 |
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)检验滤液中存在Fe3+的方法是取少量滤液于试管,滴加KSCN溶液,溶液变为红色,则滤液中有Fe3+(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.7;
(Ⅱ)加热,产生大量红褐色沉淀,静置,上层溶液呈紫红色;
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的:将Fe2+氧化为Fe3+;调节溶液的pH为3.7的目的是调节pH值使铁元素沉淀完全,此时溶液中c(Fe3+)为1.1×10-5.1mol•L-1
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成有黄绿色气体,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)
12.Na2O2、HCl、Al2O3三种物质溶于水中,完全反应后,测得所得溶液中只含有AlO2-、Na+、Cl-(不考虑AlO2-的水解),则Na2O2、HCl、Al2O3的物质的之比( )
| A. | 4:6:1 | B. | 8:6:1 | C. | 3:3:1 | D. | 2:2:2 |
16.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.
该加碘食盐中添加的是KIO3(填化学式),根据图表中信息,可推测该添加物在受热时容易分解.
| 配料表 | 精制海盐.碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(2007)第005号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封.避光.防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
 .
. 铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛. .
.