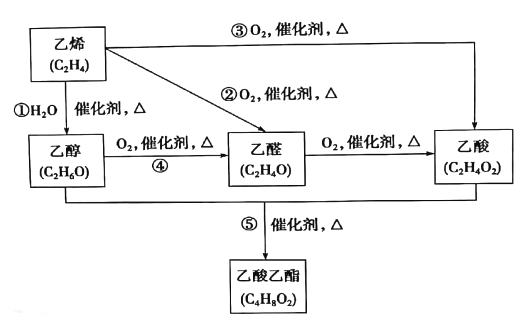
题目内容
【题目】下列实验操作和现象能获得相应实验结论的是
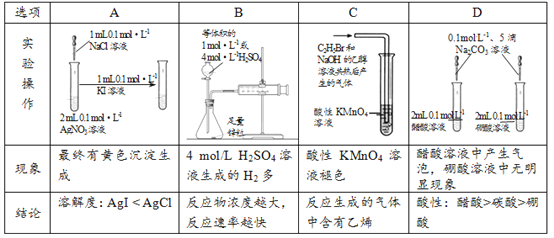
A. A B. B C. C D. D
【答案】D
【解析】A. 将1mL、0.1mol/L的NaCl溶液滴入到2mL、0.1mol/LAgNO3溶液中,AgNO3过量,将反应后的溶液加入到1mL、0.1mol/L的KI溶液中,一定有AgI黄色沉淀生成,所以不能判断AgI和AgCl溶解度的大小,故A错误;B. 因Zn足量,则生成氢气的多少只与溶液中氢离子的物质的量有关,与反应速率无关,故B错误;C. 因反应生成的气体中含有挥发出的乙醇杂质,乙醇也可使酸性高锰酸钾溶液褪色,所以不能证明反应生成的气体中是否含有乙烯,故C错误;D. 将碳酸钠溶液分别滴入到醋酸和硼酸溶液中,醋酸溶液中产生气泡,说明反应生成了CO2,则醋酸的酸性强于碳酸,硼酸溶液中无明显现象,说明硼酸与碳酸钠未反应,则碳酸的酸性强于硼酸,所以酸性:醋酸>硼酸,故D正确;答案选D。

练习册系列答案
相关题目
【题目】部分弱酸的电离平衡常数如表所示:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
下列选项错误的是( )
A. 2CN-+H2O+CO2===2HCN+CO![]()
B. 2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
C. 中和等体积,等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 等体积等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者