题目内容
【题目】某化合物X有三种元素组成,某学习小组进行了如下实验:
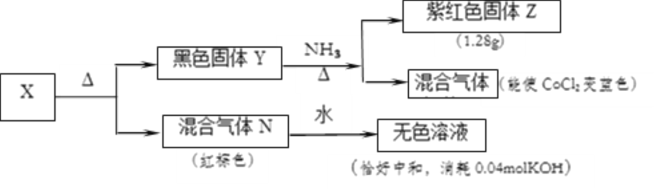
(1)化合物X的化学式为___________
(2)混合气体N通入足量的NaOH溶液中,恰好完全反应生成一种盐,其离子反应方程式为______________。
(3)黑色固体Y与NH3的化学方程式为____________
(4)若以X 3H2O进行实验,在170℃时可以生成一种中间产物W。 0.1mol化合物W能与0.6molHCl刚好完全反应,若0.1mol化合物W再继续加热生成黑色固体Y的质量为32.0g。则化合物W的化学式为______________。
(5)混合气体N有毒,为保护环境,可以用保险粉(Na2S2O4)吸收。请说明混合气体N能用保险粉吸收的理由___________。
【答案】Cu(NO3)2 4NO2+O2+4OH—=4NO3—+2H2O 3CuO+2NH3=3Cu+N2+3H2O Cu4(OH)6(NO3)2或Cu(NO3)2 3Cu(OH)2 NO2有氧化性,Na2S2O4中+3价的硫元素具有还原性,能发生氧化还原反应
【解析】
对X进行加热后分解产生了红棕色的混合气体,混合气体中一定有NO2,所以X中一定有N和O元素; X分解产生的黑色固体与NH3反应后,可以获得紫红色固体,即铜单质,所以X中一定有Cu元素,所以X为Cu(NO3)2。
(1)通过分析可知,X的化学式即为Cu(NO3)2;
(2)通过分析可知Cu(NO3)2分解的方程式为:![]() ,所以混合气体与足量NaOH溶液反应的离子方程式为:
,所以混合气体与足量NaOH溶液反应的离子方程式为:![]() ;
;
(3)通过分析可知黑色固体Y即为CuO,其与NH3反应的方程式为:![]() ;
;
(4)0.1molW能消耗0.6molHCl,所以W化学式中含有6个OH-;又因为,0.1molW分解得到Y(CuO)质量32.0g即0.4mol,所以W的化学式中含有4个Cu2+,所以W的化学式为Cu4(OH)6(NO3)2;
(5)混合气体中含有NO2,具有氧化性,其可以与具有还原性的Na2S2O4发生氧化还原反应,从而转化成无毒的N2。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案