题目内容
【题目】按要求填空:
(1)常温下0.1moL/L 盐酸和0.06mol/L氢氧化钡溶液以等体积混合后pH=______
(2)常温下pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则混合溶液的pH=_______(己知lg2=0.3,lg5=0.7)
(3)如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y, 起始时VA=VB=a L。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+ W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA=1.2aL,试回答:
2Z+ W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA=1.2aL,试回答:
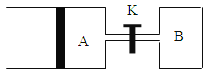
①A中的X的转化率 αA=__________;
②A、B中X的转化率αA ______αB (填“>、=、<”)
③打开K,一段时间后又达到平衡时,A 的体积为_______ L(连通管中的气体体积不计)
【答案】(1)12;(2)11.3;(3)①40%;②>;③2.6aL
【解析】
试题分析:(l)常温下0.1mol/L 盐酸和0.06mol/L氢氧化钡溶液以等体积混合后氢氧化钡过量,则混合后溶液中氢氧根浓度为![]() ,因此溶液中氢离子浓度为10-12mol/L,则溶液的pH=12。
,因此溶液中氢离子浓度为10-12mol/L,则溶液的pH=12。
(2)常温下pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则混合溶液中氢氧根浓度为![]() ,则溶液中氢离子浓度为5×10-12mol/L,所以溶液的pH=11.3。
,则溶液中氢离子浓度为5×10-12mol/L,所以溶液的pH=11.3。
(3)①A为恒温恒压过程,达到平衡时VA=1.2a L,等压等温条件下,气体的体积之比等于气体的物质的量之比,所以平衡后混合气体的物质的量是2mol×1.2=2.4mol,设参加反应的X的物质的量为m mol,则:X(g)+Y(g)![]() 2Z(g)+W(g) 物质的量增多
2Z(g)+W(g) 物质的量增多
1mol 1mol
mmol (2.4﹣2)mol
解得m=0.4
所以X物质的转化率=![]() ×100%=40%;
×100%=40%;
②A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积不变的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B中压强增大平衡逆向进行,X的转化率减小,平衡后A中的X的转化率大于B中X的转化率;
③打开K达新平衡等效为A中到达的平衡,X的转化率为40%,参加反应的X的总的物质的量为3mol×40%=1.2mol,则:
X(g)+Y(g)2Z(g)+W(g) 物质的量增多
1mol 1mol
1.2mol 1.2mol
故平衡后容器内总的物质的量为(1mol+1mol+2mol+2mol)+1.2mol=7.2mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为aL×![]() =3.6a,则A的体积为3.6a﹣a=2.6a。
=3.6a,则A的体积为3.6a﹣a=2.6a。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案