题目内容
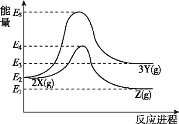
【题目】已知:还原性HSO3->I-,氧化性IO3->I2>SO42-,在含0.3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
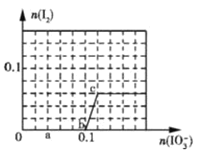
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3- ═3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中的I-为0.04 mol时,加入的KIO3只能是0.04mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
【答案】C
【解析】
还原性HSO3->I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO3->I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,
A.0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是0.1mol,亚硫酸氢钠的物质的量是0.3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3- ═3SO42-+I-+3H+,选项A正确;
B.a点碘酸钾的物质的量是0.04mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的=![]() =0.12mol,选项B正确;
=0.12mol,选项B正确;
C.当溶液中的I-为0.04mol时,有两种情况:
一是只发生反应IO3-+6H++5I-═3H2O+3I2,生成I-为0.04mol,根据碘元素守恒n(KIO3)=n(I-)=0.04mol;
二是HSO3-反应完毕后,还发生IO3-+6H++5I-═3H2O+3I2,剩余I-为0.04mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H++5I-═3H2O+3I2中消耗的I-为0.1mol-0.04mol=0.06mol,消耗KIO3的物质的量为0.06mol×![]() =0.012mol,故共加入的KIO3为0.1mol+0.012mol=0.112mol,选项C不正确;
=0.012mol,故共加入的KIO3为0.1mol+0.012mol=0.112mol,选项C不正确;
D.根据图象知,b点碘酸根离子完全反应生成碘离子,所以其还原产物可能是碘化钠或碘化钾,b-c段内,碘离子部分被氧化生成碘单质,所以b~c间的还原产物是I2,选项D正确;
答案选C。

【题目】氨气可有效消除NO2的污染,相关反应为8NH3+6NO27N2+12H2O,在1 L恒容密闭容器中,控制不同温度,分别加入0.50 mol NH3和1.2 mol NO2,测得n(NH3)随时间变化的有关实验数据如下表。
温度 n(NH3)/mol 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | 0.50 | 0.30 | 0.20 | … | 0.18 |
下列说法正确的是( )
A.T1温度下,0-20 min内,NO2的降解速率为0.0125 molL-1min-1
B.实验条件为T1<T2,且该反应为放热反应
C.40 min时,表格中T2对应的数据为0.20
D.0~10 min内,T1温度下NH3的降解速率大于T2温度下的