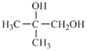题目内容
【题目】NH4HSO4溶液中,离子浓度由大到小的顺序正确的是
A. c(NH4+)>c(SO42-)>c(H+)>c(OH-) B. c(H+)>c(SO42-)> c(NH4+)> c(OH-)
C. c(SO42-)> c(NH4+)> c(H+)> c(OH-) D. c(SO42-)> c(NH4+)> c(OH-)>c(H+)
【答案】B
【解析】
NH4HSO4属于强酸弱碱盐, HSO4-= H++ SO42+,NH4+部分水解导致溶液呈酸性,则c(H+)> c(SO42+)> c(NH4+)>c(OH-),故B选项正确;A,C,D均不符合,所以错误,本题的正确选项为:B。

 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】50mL 0.55molL﹣1盐酸与50mL 0.50molL﹣1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是: .
(3)若实验中改用50mL 0.55molL﹣1醋酸溶液进行反应,与上述实验相比,所放出的热量(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55molL﹣1硫酸与25mL 0.50molL﹣1Ba(OH)2溶液代替上述反应,所求得的中和热△H (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1gcm﹣3 , 反应后混合溶液的比热容c=4.18J(g℃)﹣1 . 实验数据如表:根据上表中所测数据,通过计算得到中和热△H=kJ/mol(保留一位小数).
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
① | 20.3 | 20.3 | 23.6 |
② | 20.3 | 20.3 | 23.7 |
③ | 20.3 | 20.3 | 25.9 |
④ | 20.3 | 20.3 | 23.8 |
(6)下列操作能引起△H偏大的是:(填序号)操作.
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.