题目内容
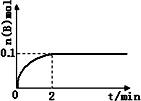
(1)在一定温度下,向1 L体积固定的密闭容器中加入1 mol A(g),发生反应2A(g)![]() B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
a.平衡常数
b.A的平衡浓度
c.平衡时混合气体的密度
d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大.
a.NaNO3
b.CuSO4
c.Na2SO4
d.NaHSO3
e.CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为________.
(4)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________.
答案:
解析:
解析:
|
(1)0.1 mol/(L·min) b c (2)向右 b (3)4a NA (4)-259.7 kJ·mol-1 (5)6 |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为 
 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)