题目内容
【题目】叠氮化钾(![]() )能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
)能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
I.制备
步骤1:制备亚硝酸丁酯(![]() )
)
![]()
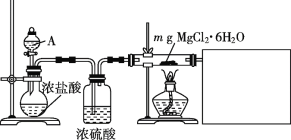
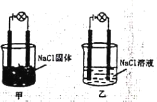
反应装置如图1(夹持装置略去),向烧杯中依次加入稀硫酸、丁醇、亚硝酸钠溶液,待反应完全后,分离出上层油状物,用![]() 和
和![]() 的混合溶液洗涤三次,经干燥后备用。
的混合溶液洗涤三次,经干燥后备用。
步骤2:制备叠氮化钾
![]()
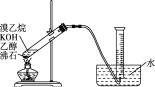
反应装置如图2(夹持及加热装置路去),向仪器A中加入![]() 乙醇溶液、
乙醇溶液、![]() 的联氨(
的联氨(![]() )、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于
)、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于![]() 干燥。
干燥。


相关物质性质如下:
物质 | 颜色、状态 | 沸点(℃) | 溶解性 |
| 无色晶体 | 受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
| 无色液休 | 118 | 微溶于水,与乙醇、乙醚混溶 |
| 无色或淡黄色油状液体 | 78 | 不溶于水,与乙醇、乙醚混溶 |
| 无色油状液体 | 118 | 与水、乙醇混溶,不溶于乙醚 |
请回答:
(1)仪器A的名称为_____________.
(2)步骤1中分离出亚硝酸丁酯的操作名称为_____________;步骤1中用NaCl和NaHCO3的混合溶液洗涤的目的是__________________________.
(3)步骤2中冰浴冷却的目的是__________________________;步骤2中干燥产品的温度控制在55~60℃,原因是__________________________
(4)如需提高产品的纯度,可在_____________(填编号)中进行重结晶。
A.无水乙醇 B.无水乙醚 C.水 D.乙醇的水溶液
Ⅱ.分光光度法测定产品的纯度
原理:![]() 与
与![]() 反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“
反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“![]() 吸光度”曲线确定样品溶液中的
吸光度”曲线确定样品溶液中的![]() 。测定步骤如下:
。测定步骤如下:
①用![]() 品体配制
品体配制![]() 标准溶液;
标准溶液;
②配制一组相同体积(![]() )不同浓度的
)不同浓度的![]() 标准溶液,分别加入
标准溶液,分别加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测量吸光度,绘制标准溶液的
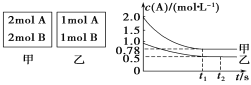
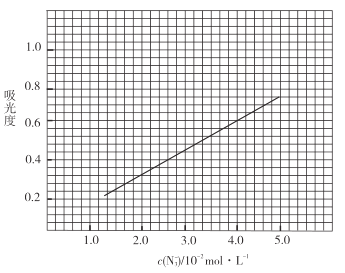
标准溶液,摇匀,测量吸光度,绘制标准溶液的![]() 与吸光度的关系曲线,如图;
与吸光度的关系曲线,如图;
③产品测定:称取0.360g产品,配成![]() 溶液,取出
溶液,取出![]() 于标准管中,加入
于标准管中,加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测得吸光度为0.6。
标准溶液,摇匀,测得吸光度为0.6。
(5)实验室用![]() 晶体配制
晶体配制![]() 标准溶液的方法为_________________.
标准溶液的方法为_________________.
(6)产品的纯度为_________________;若③中加入的![]() 标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。
标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。
【答案】三颈烧瓶(或三颈瓶) 分液 洗去亚硝酸丁酯中混有的酸 降低产品的溶解度,提高产率 温度过低,则干燥时间较长;温度过高导致产品分解 D 称取一定质量的晶体,溶于盐酸中,加水稀释后再转移至容量瓶中定容 90% 偏低
【解析】
I.(1)依据仪器的结构与用途作答;
(2)酯类与水互不相容,据此选择混合物的分离方法;制备过程中需除去亚硝酸;
(3)依据KN3受热易分解,结合温度对KN3溶解度的影响作答;
(4)根据KN3易溶于水,微溶于乙醇,不溶于乙醚的物理性质作答;
Ⅱ.(5)结合氯化铁溶液中铁离子水解的特点,进行实验的规范操作;
(6)依据曲线吸光度对应的![]() ,计算求得
,计算求得![]() 的质量,进而求出纯度;依据错误操作对标准液浓度的误差分析判断。
的质量,进而求出纯度;依据错误操作对标准液浓度的误差分析判断。
I.(1)仪器A的名称为三颈烧瓶;
(2)上层油状物即为亚硝酸丁酯,所以分离方法是分液;步骤1中,用NaCl和NaHCO3的混合溶液洗涤主要是为了除去亚硝酸,故答案为:分液;洗去亚硝酸丁酯中混有的酸;
(3)叠氮化钾析出后,用冰浴冷却是为了降低产品的溶解度,提高产率。温度过低,则干燥时间较长;温度过高导致产品分解。
(4)产品不溶于乙醇、乙醚,排除A、B项,产品中的有机杂质不易溶于水,故用乙醇水溶液可以有效溶解有机杂质,同时也有利于产品再次结晶析出,故答案为:D。
Ⅱ.(5)铁离子强烈水解,故配制铁盐溶液时,先将其溶于对应的酸中以抑制铁离子水解,再加水稀释。由于此处需配制标准溶液,所以用容量瓶定容,故答案为:称取一定质量的晶体,溶于盐酸中,加水稀释后再转移至容量瓶中定容。
(6)根据曲线图,吸光度0.6对应的![]() 为
为![]() ,则
,则![]() 产品中含有
产品中含有![]() 的质量为
的质量为![]() ,纯度为
,纯度为![]() ;若加入的
;若加入的![]() 标准溶液不足,则溶液中的
标准溶液不足,则溶液中的![]() 无法完全反应,测得的
无法完全反应,测得的![]() 比实际浓度低,测得的纯度偏低,故答案为:90%;偏低。
比实际浓度低,测得的纯度偏低,故答案为:90%;偏低。

【题目】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) | H2NCOONH4(l)
|
快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:____________________________,该反应热为![]() ,则
,则![]() ______________(“大于”“小于”或“等于”)
______________(“大于”“小于”或“等于”)![]() 。
。
(2)下列说法正确的是________________。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比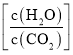 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为![]() 时(
时(![]() ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比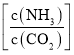 的变化如表所示:
的变化如表所示:
氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________.
(4)一定条件下,在图中绘制氨基甲酸铵(![]() )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
 _______________
_______________
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________.

【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A. 表中V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1