题目内容
 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.(1)氢气燃烧热值高.实验测得常温常压下,1g H2完全燃烧生成液态水,放出142.9kJ热量,则表示H2的标准燃烧热的热化学方程式为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
.(2)氢氧燃料电池能量转化率高,具有广阔的发展前景.用氢氧燃料电池进行下图所示实验(其中下图中电极均为惰性电极):该氢氧燃料电池中,b极的电极反应式为
H2+2e-+2OH-=2H2O
H2+2e-+2OH-=2H2O
;d极的电极反应式为4OH--4e-=O2+2H2O
4OH--4e-=O2+2H2O
;若标准状况下氧气消耗为5.6L,则导线中转移的电子的物质的量为1mol
1mol
.分析:(1)根据燃烧热的含义:完全燃烧1mol物质生成最稳定的化合物所放出的热以及热化学方程式的书写方法来回答;
(2)在氢氧燃料电池中,通入氢气的电极为负极,发生氧化反应,和电源的负极相连的是阴极,通入氧气的电极为正极,发生还原反应,和电源的正极相连的是阳极,根据电极反应式可以确定电子转移情况.
(2)在氢氧燃料电池中,通入氢气的电极为负极,发生氧化反应,和电源的负极相连的是阴极,通入氧气的电极为正极,发生还原反应,和电源的正极相连的是阳极,根据电极反应式可以确定电子转移情况.
解答:解:(1)根据热化学方程式的含义,H2的标准燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8 kJ/mol,
故答案为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8 kJ/mol;
(2)在氢氧燃料电池中,通入氢气的电极b为负极,发生氧化反应,在碱性环境下,电极反应为:H2+2e-+2OH-=2H2O,通入氧气的电极为正极,发生还原反应O2+2H2O+4e-=4OH-,和电源的负极相连的c是阴极,所以d是阳极,该机的电极反应式为:4OH--4e-=O2+2H2O,若标准状况下氧气消耗为5.6L即0.25mol,据反应O2+2H2O+4e-=4OH-,导线中转移的电子的物质的量为1mol,故答案为:H2+2e-+2OH-=2H2O;4OH--4e-=O2+2H2O;1mol.
故答案为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8 kJ/mol;
(2)在氢氧燃料电池中,通入氢气的电极b为负极,发生氧化反应,在碱性环境下,电极反应为:H2+2e-+2OH-=2H2O,通入氧气的电极为正极,发生还原反应O2+2H2O+4e-=4OH-,和电源的负极相连的c是阴极,所以d是阳极,该机的电极反应式为:4OH--4e-=O2+2H2O,若标准状况下氧气消耗为5.6L即0.25mol,据反应O2+2H2O+4e-=4OH-,导线中转移的电子的物质的量为1mol,故答案为:H2+2e-+2OH-=2H2O;4OH--4e-=O2+2H2O;1mol.
点评:本题考查学生热化学和电化学的有关知识,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.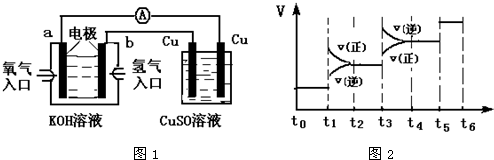
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.