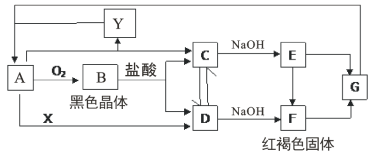
题目内容
【题目】由丙烯经下列反应制得F、G两种高分子化合物,它们都是常用的塑料。

(1)F的结构简式为________。
(2)在一定条件下,两分子E能脱去两分子形成一种六元环状化合物,该化合物的结构简式为_______。
(3)①B→C 化学方程式为______。
②C与含有NaOH的Cu(OH)2悬浊液反应的化学方程式为______。
③E→G化学方程式为______。
(4)手性分子X为E的一种同分异构体,lmolX与足量金属钠反应产生lmol氢气,lmolX与足量银氨溶液反应能生成2molAg,则X的结构简式为_______。
(5)用G代替F制成一次性塑料餐盒的优点是_______。
【答案】![]()
![]()
![]()
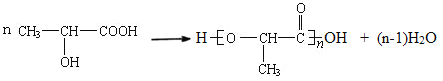
![]() 聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。
聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。
【解析】
丙烯发生加聚反应生成F,F是聚丙烯;丙烯与溴发生加成反应生成A,A是1,2-二溴丙烷;A水解为B,B是1,2-丙二醇;B氧化为C,C是![]() ;
;![]() 被新制氢氧化铜悬浊液氧化为D,D是
被新制氢氧化铜悬浊液氧化为D,D是![]() ;
;![]() 与氢气发生加成反应生成E,E是
与氢气发生加成反应生成E,E是![]() ;
;![]() 发生缩聚反应生成高分子化合物G为
发生缩聚反应生成高分子化合物G为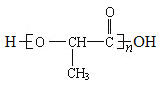 。
。
(1) 丙烯发生加聚反应生成F,F是聚丙烯,结构简式为![]() 。
。
(2)E是![]() ,在一定条件下,两分子
,在一定条件下,两分子![]() 能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为
能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为 。
。
(3)①B是1,2-丙二醇被氧化为![]() , 化学方程式为
, 化学方程式为![]() 。
。
②C是![]() ,被含有NaOH的Cu(OH)2悬浊液氧化为
,被含有NaOH的Cu(OH)2悬浊液氧化为![]() ,反应的化学方程式为
,反应的化学方程式为![]() 。
。
③E是![]() ,发生缩聚反应生成聚乳酸,化学方程式为
,发生缩聚反应生成聚乳酸,化学方程式为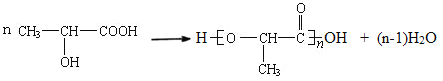 。
。
(4)手性分子X为E的一种同分异构体,lmolX与足量金属钠反应产生lmol氢气,lmolX与足量银氨溶液反应能生成2molAg,说明X中含有2个羟基、1个醛基,则X的结构简式为![]() 。
。
(5)用G代替F制成一次性塑料餐盒的优点是聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。

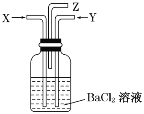
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸。

已知:①无水氯化钙可与乙醇形成微溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)圆底烧瓶中发生的化学反应方程式:________,浓硫酸的作用为________。
(2)球形干燥管C的作用是_________,D中放________溶液,其作用是________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)__________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.生石灰B.碱石灰C.无水硫酸钠
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
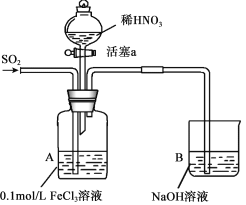
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a。 | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):________。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
(3)实验II中发生反应的离子方程式是__________________。
(4)实验III中,浅绿色溶液变为黄色的原因是__________________(用离子方程式表示)。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的化学方程式是______________。
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-。请从微粒变化的角度解释________。