题目内容
【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。人工固氮最主要的方法是Haber—Bosch法。通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
在Fe催化剂作用下的反应历程为(*表示吸附态):
化学吸附:N2(g)→2N* ;H2(g)→2H*;
表面反应:N*+H*NH*;NH*+H*NH2*;NH2*+H*NH3*;
脱附:NH3*NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
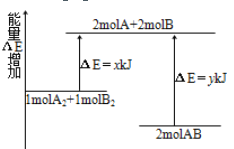
(1)已知合成氨反应中生成1 mol NH3放出46kJ热量,该反应的热化学方程式为______
(2)实际生产中,原料气中N2和H2物质的量之比为1:2.8。分析说明原料气中N2过量的理由________。
(3)关于合成氨工艺的下列理解,正确的是____________。
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.原料中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防止催化剂中毒和安全事故发生
(4)已知反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)标准平衡常数
H2(g)NH3(g)标准平衡常数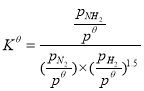 ,其中
,其中![]() 为标准压强(1×105Pa),
为标准压强(1×105Pa),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如:
为各组分的平衡分压,如:![]() =
=![]() ,p为平衡总压,
,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数。
为平衡系统中NH3的物质的量分数。
若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为![]() ,则
,则![]() =_________(用含
=_________(用含![]() 的最简式表示)。
的最简式表示)。
(5)常温常压下电解法合成氨的原理如图所示:
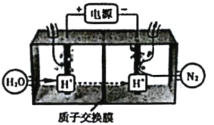
①阴极生成氨的电极反应式为__________。
②阳极产物只有O2,电解时实际生成的NH3的总量远远小于由O2理论计算所得NH3的量,结合电极反应式解释原因:___________________。
【答案】N2(g)+3H2(g)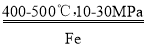 2NH3(g) △H=-92kJ﹒mol-1 原料气中N2:相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。 ACD
2NH3(g) △H=-92kJ﹒mol-1 原料气中N2:相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。 ACD ![]() N2+6H++6e-=2NH3 还可能发生2H++2e-=H2↑,N2+8H++6e-=2NH4+
N2+6H++6e-=2NH3 还可能发生2H++2e-=H2↑,N2+8H++6e-=2NH4+
【解析】
(1)已知合成氨反应中生成1 mol NH3放出46kJ热量,则2mol NH3放出92 kJ热量,该反应的热化学方程式为N2(g)+3H2(g)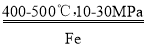 2NH3(g) △H=-92kJ﹒mol-1 ,故答案为:N2(g)+3H2(g)
2NH3(g) △H=-92kJ﹒mol-1 ,故答案为:N2(g)+3H2(g)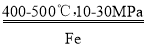 2NH3(g) △H=-92kJ﹒mol-1 ;
2NH3(g) △H=-92kJ﹒mol-1 ;
(2)实际生产中,原料气中N2和H2物质的量之比为1:2.8。原料气中N2过量的理由原料气中N2,相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。故答案为:原料气中N2,相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率;
(3)A.合成氨反应是气体体积减小的放热反应,在不同温度下的ΔH和ΔS都小于零,故A正确;
B.控制温度远高于室温,是为了保证催化剂活性最高,故B错误;
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,减小生成物浓度,利于反应正向进行,故C正确;
D.原料中N2由分离液态空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防止催化剂中毒和安全事故发生,故D正确;
故答案为:ACD;
(4)若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为![]() ,
,
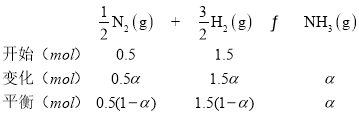
平衡混合气体总物质的量=[0.5(1-a)+1.5(1-a)+a]mol=(2-a)mol,p为平衡时压强,p(N2)=![]() ,p(H2)=
,p(H2)=![]() ,p(NH3)=
,p(NH3)=![]() ,Kθ=
,Kθ=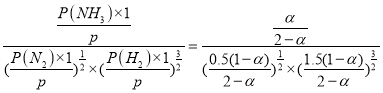 ,则Kθ=
,则Kθ=![]() (用含
(用含![]() 的最简式表示)。故答案为:
的最简式表示)。故答案为:![]() ;
;
(5)①阴极与电源负极相连,为N2放电生成NH3,阴极生成氨的电极反应式为N2+6H++6e-=2NH3 ;故答案为:N2+6H++6e-=2NH3 ;
②电解时实际生成的NH3的总量远远小于由O2理论计算所得NH3的量,原因是电解时,阴极除了N2得电子外,还可能发生N2+8H++6e-=2NH4+,2H++2e-=H2。故答案为:还可能发生2H++2e-=H2↑,N2+8H++6e-=2NH4+。