题目内容
12.已知A、B、C、D、E是原子序数依次增大的五种短周期元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 元素A、B组成的化合物常温下一定呈气态 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 元素B、C、D的最高价氧化物对应的水化物两两之间均可发生化学反应 |
分析 A、B、C、D、E是原子序数依次增大的五种短周期元素,元素C在同周期的主族元素中原子半径最大,C为Na;元素B的原子最外层电子数是其电子层数的2倍,B为第二周期元素,则B为C;元素D的合金是日常生活中常用的金属材料,D为Al,其中元素A、E的单质在常温下呈气态,A为H,E为Cl,以此来解答.
解答 解:由上述分析可知,A为H,B为C,C为Na,D为Al,E为Cl,
A.Na、Al为活泼金属,Cl为活泼非金属,则工业上常用电解法制备元素C、D、E的单质,如电解熔融氯化钠生成Na、氯气,电解熔融氧化铝冶炼Al,故A正确;
B.元素A、B组成的化合物为苯时,常温下为液体,为大分子烃时为固体,故B错误;
C.HCl只含共价键,NaCl只含离子键,故C错误;
D.B、C、D的最高价氧化物对应的水化物分别为碳酸、NaOH、高氯酸,碳酸与高氯酸不反应,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置、原子序数来推断元素为解答的关键,侧重分析与应用能力的考查,C为Na为元素推断的突破口,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
15.电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.下列判断正确的是( )
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,将电能转化成化学能 | |
| D. | 原电池工作时,负极区溶液pH增大 |
16.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号)
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极 (填“锌极”或“铜极”)
| ①Zn为正极,Cu为负极 ②H+向负极移动 ③Cu极有H2产生 ④电子流动方向Zn→Cu ⑤正极的电极反应式是Zn-2e-=Zn2+ ⑥若有1mol电子流过导线,则理论上产生0.5mol H2 |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极 (填“锌极”或“铜极”)
13.下列说法正确的是( )
①离子化合物含离子键,也可能含极性键或非极性键
②HClO酸性<H2CO3酸性,故非金属性Cl<C
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的化合物是离子化合物
⑥由分子组成的物质中一定存在共价键.
①离子化合物含离子键,也可能含极性键或非极性键
②HClO酸性<H2CO3酸性,故非金属性Cl<C
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的化合物是离子化合物
⑥由分子组成的物质中一定存在共价键.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②③⑤ | D. | ①③⑤⑥ |
1.某研究性学习小组进行电化学实验,研究装置如图所示.有关说法不正确的是( )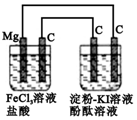

| A. | 电解池中阳极区溶液变红,阴极区溶液变蓝 | |
| B. | 原电池中碳极的电极反应式为:Fe3++e-═Fe2+ | |
| C. | 镁为负极,发生氧化反应 | |
| D. | 电解池中阴极的电极反应式为:2H++e-═H2↑ |
16.下列说法不正确的是( )
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 石灰石烧制石灰是吸热反应 | |
| C. | 反应的活化能越大,该化学反应前后的能量变化就越大 | |
| D. | 将AgNO3溶液滴加到KC1溶液中,反应的活化能几乎为零 |

 充分还原的产物与其充分催化氧化的产物发生酯化反应,其中含有一个酯基的产物种类是( )(不考虑立体异构)
充分还原的产物与其充分催化氧化的产物发生酯化反应,其中含有一个酯基的产物种类是( )(不考虑立体异构)