题目内容
对于第三周期元素的有关叙述错误的是
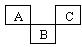
| A.碱性:NaOH > Mg(OH)2> Al(OH)3 |
| B.电负性:Si< P < S |
| C.第一电离能:Na < Mg < Al |
| D.Cl-核外电子排布式:1s22s22p63s23p6 |
C
答案:C
A、正确,从左到右,最高价氧化物的碱性减弱NaOH > Mg(OH)2 > Al(OH)3
B、正确,从左到右,原子半径变小,电负性变大:Si < P < S
C、不正确,Mg的2s2轨道是全滿结构,第一电离能变大:Na < Al< Mg
D、正确。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目