题目内容
G是合成双酚A的原料,其结构简式如图,关于G说法不正确的是
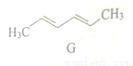
A. 分子式为C6H10
B. 是乙烯的同系物
C. 可以发生加成反应
D. 难溶于水
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案根据下表中有关短周期元素性质的数据,下列说法不正确的是( )
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
原子半径(10﹣10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
主要化合价 | 最高价 | / | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
最低价 | ﹣2 | / | / | ﹣3 | ﹣1 | / | ﹣3 | / | |
A. 元素原子序数④大于⑦ B. ②③号元素不可能处于同一周期
C. ⑤号元素最高价氧化物对应水 化物的酸性最强 D. ⑧号元素是金属元素
化物的酸性最强 D. ⑧号元素是金属元素
氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,
制备氯化亚铜的生产工艺如下:
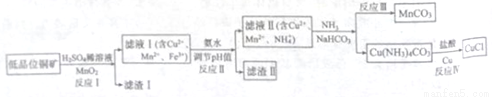
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大




 可形成配合物。
可形成配合物。