题目内容
15.下列关于价电子构型为3s23p4的粒子描述正确的是( )| A. | 它的原子核外电子共有16种不同的运动状态 | |
| B. | 它的原子核外有三种形状不同的电子云 | |
| C. | 它可与H2反应生成常温时的液态化合物 | |
| D. | 核外电子轨道表示式为: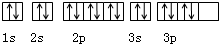 |
分析 A.原子核外电子运动状态和该原子的核外电子数相等;
B.电子云的形状种数由该原子能级种类确定;
C.硫与氢气反应生成硫化氢为常温时的气态化合物;
D.3p能级上电子排布图违反洪特规则.
解答 解:A.S原子具有16个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有16种不同的运动状态,故A正确;
B.价电子构型为3s23p4的元素是16号元素S,具有s和p两种能级,因此该原子的电子云形状有两种,故B错误;
C.硫和氢气化合生成的硫化氢,常温时的气态化合物,故C错误;
D.电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以3p能级上电子排布图违反洪特规则,故D错误;
故选:A.
点评 本题考查原子核外电子排布,明确构造原理、洪特规则等知识点是解本题关键,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 强酸性的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 强碱性的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
3.下列物质中,原子间全部是通过共价键形成的是( )
| A. | NaOH | B. | NaCl | C. | H2SO4 | D. | (NH4)2SO4 |
20.下列关于实验的说法中,不正确的是( )
| A. | 用加热分解的方法可区分碳酸钠和碳酸氢钠两种固体 | |
| B. | 向某溶液中加入过量的浓盐酸,有白色沉淀生成,该溶液中可能含SiO32- | |
| C. | 向某溶液中加入盐酸酸化的BaC12溶液,有白色沉淀生成,该溶液中一定含SO42- | |
| D. | 配制0.1000mol/L氢氧化钠溶液时,将液体转移到容量瓶中,需用玻璃棒引流 |
7.制造水泥和普通玻璃都需要的原料是( )
| A. | 石灰石 | B. | 粘土 | C. | 纯碱 | D. | 硅酸钠 |
4.下列说法不正确的是( )
| A. | 金刚石、氮化硼、碳化硅、石英、晶体硅、锗、刚玉均为原子晶体 | |
| B. | 干冰晶体、C60晶体、冰晶体、铜晶体中一个分子或金属原子周围有12个紧邻的分子或金属原子 | |
| C. | 面心立方最密堆积按ABABAB…的方式堆积,配位数为12,空间利用率为74% | |
| D. | 焰色反应的实质是发射光谱 | |
| E. | 第二主族金属元素的碳酸盐受热分解温度会越来越高,原因是晶格能越来越大. |
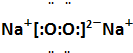 ,其晶体中所含化学键的类型有离子键、共价键(非极性共价键).
,其晶体中所含化学键的类型有离子键、共价键(非极性共价键).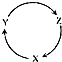 下列各组物质中,满足下如图物质一步转化关系的选项是( )
下列各组物质中,满足下如图物质一步转化关系的选项是( )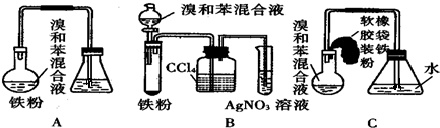
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$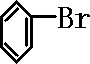 +HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.
+HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.