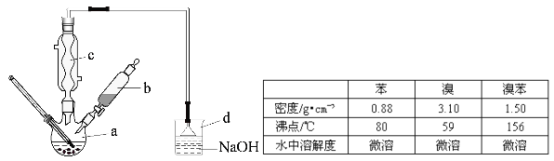
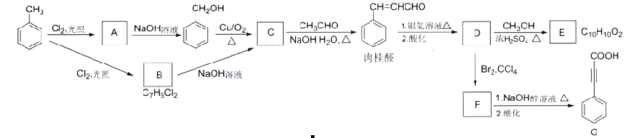
题目内容
【题目】用Li和石墨的复合材料以及纳米Fe2O3材料作电极的锂离子电池,在循环充放电过程中可实现对磁性的可逆调控(如图)。下列有关说法一定错误的是

A. 该电池的电解质溶液可以是硫酸溶液
B. 放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe
C. 充电时,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+
D. 充放电过程中,电池可在被磁铁不吸引和吸引之间循环调控
【答案】A
【解析】
A.因为该电池中含有Li和Fe2O3,都可以与硫酸反应,故A错误;
B.放电时,Li作为负极,失电子被氧化,阳极Fe2O3得电子被还原,故放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe,故B正确;
C.充电时,阳极与正极相反,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+,故C正确;
D.根据题目的示意图,充电过程是从右往左的过程,可以看到电池没有被磁铁吸引,因为充电过程的物质转化过程是由Fe和Li2O转化为Li和Fe2O3,因此充电时电池不能被磁铁吸引,放电过程的物质转化是由Li和Fe2O3转化为Fe和Li2O,有铁生成,因此放电时电池被磁铁吸引,故D正确;
故选A。

【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。
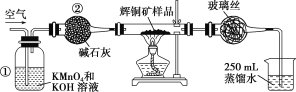
实验原理:Cu2S+O2![]() SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000 g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1 L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为Cu2S+O2![]() SO2+2Cu。
SO2+2Cu。
F.移取25.00 mL含SO2的水溶液于250 mL锥形瓶中,用0.010 0 mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2~3次。
试回答下列问题:
(1)装置①的作用是______________;装置②的作用是____________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为___。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是____________(写一种即可)。
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。