题目内容
【题目】CO2经催化加氢可合成乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2)∶n(H2)=l∶3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2)∶n(H2)=l∶3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A.该反应的△H<0
B.曲线b代表H2O
C.N点和M点所处状态的c(H2)不一样
D.其他条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
【答案】C
【解析】本题考查了平衡移动原理的应用。根据信息可知,图所示为平衡时(注意平衡这两个字),不同温度(T)下,四种气态物质的物质的量(n)的关系;由图可知,随着温度的升高,氢气的量增多,故升高温度,平衡逆向移动,则正反应为放热反应,所以△H![]() 0,故A正确,不选;由上述推测可知,该可逆反应的正反应是放热反应,升温,平衡逆向移动,水(g)和乙烯气体都减少,根据化学方程式的系数可知,水(g)比乙烯气体减少的快,由图可知,升温b和c都减少,且b减少的要快,故b曲线为水(g),故B正确,不选;N点和M点是同一温度下的状态,所以N点和M点所处状态的c(H2)一样,故C错,选;由反应2CO2(g)+6H2 (g)
0,故A正确,不选;由上述推测可知,该可逆反应的正反应是放热反应,升温,平衡逆向移动,水(g)和乙烯气体都减少,根据化学方程式的系数可知,水(g)比乙烯气体减少的快,由图可知,升温b和c都减少,且b减少的要快,故b曲线为水(g),故B正确,不选;N点和M点是同一温度下的状态,所以N点和M点所处状态的c(H2)一样,故C错,选;由反应2CO2(g)+6H2 (g)![]() C2H4(g)+4H2O(g)可知,其他条件不变,压强增大0.2 MPa,相当于体积减小一半,氢气的浓度增大到原来的2倍,但压强增大平衡正向移动,氢气的浓度减小,但平衡时氢气的浓度大于原平衡的浓度且小于原平衡浓度的2倍,故D正确,不选。
C2H4(g)+4H2O(g)可知,其他条件不变,压强增大0.2 MPa,相当于体积减小一半,氢气的浓度增大到原来的2倍,但压强增大平衡正向移动,氢气的浓度减小,但平衡时氢气的浓度大于原平衡的浓度且小于原平衡浓度的2倍,故D正确,不选。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
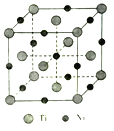
【题目】短周期非金属元素甲~丁在元素周期表中的相对位置如下表所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 |
A. 原子半径:甲<乙
B. 原子最外层电子数:甲>丁
C. 原子核外电子层数:丙>甲
D. 元素的最高价氧化物对应水化物的酸性:丁<丙