题目内容
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 molCl2与足量Fe反应转移电子数一定为3NA | |
| B. | 常温下,pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 1L 1mol•L-1的NaClO 溶液中含有ClO-的数目为NA |
分析 A、由于铁是足量的,应根据氯气的量来计算转移的电子的物质的量;
B、溶液体积不明确;
C、N2与CO的摩尔质量均为28g/mol,且均为双原子分子;
D、ClO-为弱酸根,在溶液中会水解.
解答 解:A、由于铁是足量的,应根据氯气的量来计算转移的电子的物质的量,氯气与铁反应后变为-1价,故1mol氯气转移2mol电子,即2NA个,故A错误;
B、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故B错误;
C、N2与CO的摩尔质量均为28g/mol,则14g混合气体的物质的量n=$\frac{14g}{28g/mol}$=0.5mol,而氮气和CO又均为双原子分子,则0.5mol混合气体中含1mol原子即NA个,故C正确;
D、ClO-为弱酸根,在溶液中会水解,故溶液中的次氯酸跟的个数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的计算,熟练掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.以下化学用语正确的是( )
| A. | 乙烯的结构简式CH2CH2 | B. | 羟基的电子式[:O:H]- | ||
| C. | 乙醛的分子式C2H4O | D. | 乙醇的结构式CH3CH2OH |
2.下列叙述I和II均正确且有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 铜丝深入稀硝酸溶液中,溶液变蓝 | 铜丝与硝酸发生了置换反应 |
| B | 浓硫酸具有吸水性和强氧化性 | 把浓硫酸滴到蔗糖表面,蔗糖变黑膨胀 |
| C | Fe3+具有氧化性 | FeCl3溶液用于回收废旧电路板中的Cu |
| D | BaSO4难溶于酸 | 向某溶液加入Ba(NO3)2溶液,再加入足量稀HCl,得到白色沉淀,则原溶液含SO42- |
| A. | A | B. | B | C. | C | D. | D |
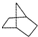
9.某有机物的结构如图所示,则下列说法中正确的是( )


| A. | 1 mol该有机物能与2 mol Na反应 | |
| B. | 该有机物能使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色 | |
| C. | 该有机物中有4种官能团 | |
| D. | 该有机物能发生加成反应但不能发生取代反应 |
6.W、X、Y、Z、M、R为6种短周期元素.W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与R原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如图所示.
(1)Z元素位于周期表第二周期ⅣA族.
(2)R离子的结构示意图为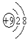 .
.
(3)Z、M、R三种元素的简单氢化物中,沸点最高的是H2O(填分子式).
(4)六种元素原子半径从大到小的顺序为Na>Al>C>O>F>H(用元素符号表示).
(5)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(6)Y4Z3能与M的简单氢化物反应生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4↑.
(7)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为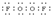 .
.
| Z | M | R | ||
| Y |
(2)R离子的结构示意图为
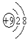 .
.(3)Z、M、R三种元素的简单氢化物中,沸点最高的是H2O(填分子式).
(4)六种元素原子半径从大到小的顺序为Na>Al>C>O>F>H(用元素符号表示).
(5)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(6)Y4Z3能与M的简单氢化物反应生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4↑.
(7)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为
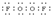 .
.
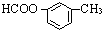
11.下列物质属于同系物的是( )
| A. |  和 和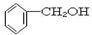 | B. | CH3CH2Cl和CH2ClCH2CH2Cl | ||
| C. | CH3COOH和C17H33COOH | D. | C2H5OH和CH4O |
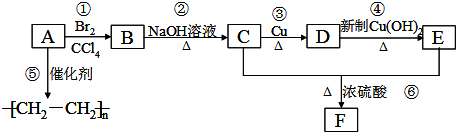
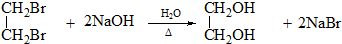
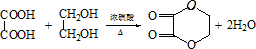 .
.

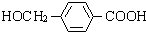 ,I
,I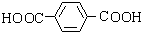 .
. ;C+D→H
;C+D→H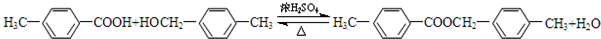 .
.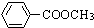 、
、 、
、
 、
、 ;
; .
.