题目内容
【题目】(1)下列物质中:①铝 ②Cl2 ③稀H2SO4 ④SO2 ⑤NH3 ⑥HCl ⑦CaCO3 ⑧Ba(OH)2 ⑨乙醇 ⑩NaCl溶液
属于电解质的是____,属于非电解质的是____,固态和熔化状态都不导电,溶于水后能导电且是非电解质的是____(用序号填写)。
(2)Al2(SO4)3的电离方程式为_____,Ba(OH)2的电离方程式为____。
(3)①和③反应的离子方程式为____,④和⑧反应的离子方程式为_____。
(4)二氧化氮是造成光化学烟雾的罪魁祸首。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨把二氧化氮还原为氮气和水。请写出该反应的化学方程式:____。
【答案】⑥⑦⑧ ④⑤⑨ ④⑤ Al2(SO4)3=2Al3++3SO42– Ba(OH)2=Ba2++2OH– 2Al+6H+=2Al3++3H2↑ Ba2++2OH-+SO2=BaSO3↓+H2O 6NO2+8NH3![]() 7N2+12H2O
7N2+12H2O
【解析】
(1)电解质和非电解质都必须是化合物;电解质在熔融状态或水溶液中能导电的化合物,非电解质是在熔融状态和水溶液中都不能导电的化合物,金属单质能导电;电解质在熔融状态或水溶液中能导电;
(2)Al2(SO4)3的电离铝离子和硫酸根离子,Ba(OH)2的电离为钡离子和氢氧根离子。
(3)①和③反应生成硫酸铝和氢气,④和⑧反应生成亚硫酸钡沉淀和水。
(4)用氨把二氧化氮还原为氮气和水,由此写出方程式。
(1)①铝是金属单质,既不是电解质也不是非电解质,但能导电;
②Cl2是非金属单质,既不是电解质也不是非电解质,但不能导电;
③稀H2SO4是混合物,既不是电解质,也不是非电解质,但能导电;
④SO2是非电解质,其溶液导电是由于二氧化硫和水反应生成了亚硫酸,本身不能够导电;
⑤NH3 是非电解质,其溶液导电是由于氨气和水反应生成了一水合氨,本身不能够导电;
⑥HCl气体是电解质,但气体本身不能够导电;
⑦CaCO3是电解质,固体不能导电;
⑧Ba(OH)2 在熔融状态或水溶液中能导电,是电解质,固体不导电;
⑨乙醇是在熔融状态和水溶液中都不能导电的化合物,是非电解质,不能导电;
⑩NaCl溶液是混合物,既不是电解质,也不是非电解质,但能导电;
属于电解质的是⑥⑦⑧,属于非电解质的是④⑤⑨,固态和熔化状态都不导电,溶于水后能导电且是非电解质的是④⑤;
(2)Al2(SO4)3能电离出铝离子和硫酸根离子,电离方程式为:Al2(SO4)3=2Al3++3SO42–,Ba(OH)2能电离出钡离子和氢氧根离子,电离方程式为:Ba(OH)2=Ba2++2OH–。
(3)①和③反应生成硫酸铝和氢气,离子方程式为:2Al+6H+=2Al3++3H2↑ ;④和⑧反应生成亚硫酸钡沉淀和水离子方程式为:Ba2++2OH-+SO2=BaSO3↓+H2O。
(4)用氨把二氧化氮还原为氮气和水,+4价的氮降为0价,-3价的氮升为0价,6NO2+8NH3![]() 7N2+12H2O。
7N2+12H2O。

 轻巧夺冠周测月考直通高考系列答案
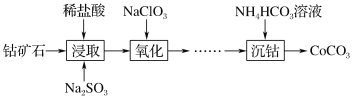
轻巧夺冠周测月考直通高考系列答案【题目】CoCO3主要用作选矿剂、伪装涂料的颜料等。用钴矿石(含Co2O3·CoO及少量Fe2O3、Al2O3、MnO2等)生产CoCO3的流程如下:
下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1)
Al3+ | Fe3+ | Fe2+ | Mn2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.7 | 7.6 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.8 | 9.2 |
(1)写出“浸取”步骤Co2O3·CoO发生反应的离子方程式 ______________________ 。
(2)“浸取”步骤除Co2O3·CoO外,钴矿石中还能被Na2SO3还原的物质有______ (填化学式)。
(3)加NaClO3的目的是氧化Fe2+,NaClO3的用量过多会造成的不良后果是 _________ 。
(4)“沉钴”步骤向CoCl2溶液加入NH4HCO3溶液需要55~57 ℃条件下进行,温度控制在
55~57 ℃的原因为 ________________________________________________________ 。
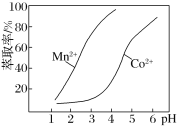
(5)已知金属萃取剂对金属离子的萃取率与pH的关系如图所示。请补充完整由“氧化”后的溶液制备CoCO3的实验方案:向“氧化”后的溶液中加入_______________________,得较纯CoCl2溶液,加入NH4HCO3溶液沉钴得CoCO3。(实验中须使用试剂:Na2CO3溶液、金属萃取剂、盐酸)。