题目内容
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
(1)提出假设
①该反应的气体产物是CO2.
②该反应的气体产物是CO.
③该反应的气体产物是________.
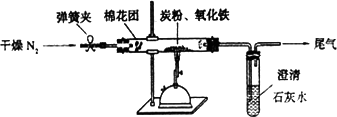
(2)设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式:________.
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20 g氧化铁、2.00 g碳粉混均匀,放入48.48 g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24 g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00 g.
步骤②、④中都分别通入N2,其作用分别为________.
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:________.
解析:
|
(1)CO2、CO的混合物 (3)NH4++NO2- (4)步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收 (5)2C+Fe2O3 |

 快捷英语周周练系列答案
快捷英语周周练系列答案二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设 不成立。
(2)若假设二成立,反应的化学方程式是 。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
|
实验步骤 (不要求写具体操作过程,仪器任选) |
预期的实验现象及结论 |
|
取适量的白色固体置于试管中,………… |
|
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由: