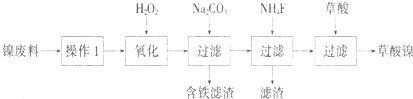
题目内容
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法正确的是( )
分析:A.若Fe为阳极,则氯离子不能在阳极生成;
B.电解时阳极附近氯离子放电;
C.电解时阳极附近氯离子放电;
D.由Ni2+-e-═Ni3+可知转移的电子数.
B.电解时阳极附近氯离子放电;
C.电解时阳极附近氯离子放电;
D.由Ni2+-e-═Ni3+可知转移的电子数.
解答:解:A.若Fe为阳极,则氯离子不能在阳极生成,则不会存在产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,故A错误;
B.电解时阳极附近氯离子放电,溶液的pH不会升高,故B错误;
C.电解时阳极附近氯离子放电,发生电极反应为2Cl--2e-═Cl2,故C错误;
D.由Ni2+-e-═Ni3+可知1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故D正确;
故选:D.
B.电解时阳极附近氯离子放电,溶液的pH不会升高,故B错误;
C.电解时阳极附近氯离子放电,发生电极反应为2Cl--2e-═Cl2,故C错误;
D.由Ni2+-e-═Ni3+可知1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故D正确;
故选:D.
点评:本题考查电解原理,明确离子的放电顺序及发生的电极反应是解答本题的关键,选项A为解答的易错点,题目难度中等.

练习册系列答案
相关题目
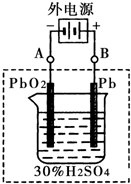 (1)铅蓄电池的电池总反应式为:
(1)铅蓄电池的电池总反应式为: