题目内容
【题目】有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用PH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为碱性;b.溶液逐渐产生沉淀
c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
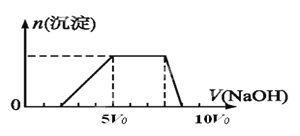
其中产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如下图所示。
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 的存在。
(2)由②可以证明 的存在;同时排除 的存在;
(3)由①③可以推知该溶液中一定含有的阳离子是 ,它们的物质的量浓度比为 。
(4)由④可以证明 的存在,同时排除 的存在。
【答案】(1) CO32-、AlO2- (2)I-;NO3-、Fe3+;
(3)Al3+、NH4+、H+;c(H+)∶c( NH4+)∶c(Al3+)=2∶3∶1
(4)Ba2+;SO42+
【解析】
试题分析:根据实验①现象:溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-发生反应而不能共存,H+与AlO2-发生反应而不能共存,说明溶液中肯定不含有CO32-、AlO2-;
根据实验②现象:CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而I-与Fe3+、NO3-、H+发生反应而不能共存,说明溶液中肯定不含有Fe3+、NO3-;
根据实验③现象溶液逐渐产生沉淀,c.沉淀完全溶解,说明溶液中肯定含有Al3+、一定不含Mg2+;d.最后加热溶液,有气体放出,产生的气体能使湿润的红色石蕊试纸变蓝,说明溶液中肯定含有NH4+;根据图像c(H+)∶c( NH4+)∶c(Al3+)=2∶3∶1
根据实验④现象:取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-;。

【题目】已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如下表。
氢氧化物 | 溶液pH | |||
开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.4 | —— | —— |
Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。以下推断错误的是

A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)