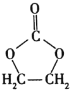
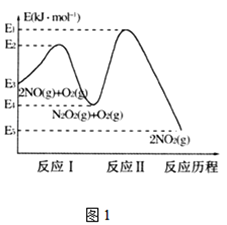
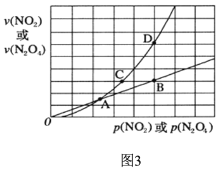
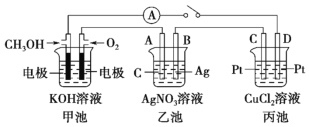
题目内容
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是

甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D
【答案】B
【解析】
A. 乙烯与HCl加成得到一氯乙烷,一氯乙烷消去得到乙烯与HCl,一氯乙烷与水发生取代得到乙醇,乙醇消去得到乙烯与水,符合转化,A项正确;
B. HNO3显酸性,NH3显碱性,由硝酸不能直接转化为氨气,不能实现转化,B项错误;
C. AlCl3与氨水反应得到Al(OH)3,Al(OH)3与盐酸反应得到AlCl3与水,Al(OH)3加热分解得到Al2O3,Al2O3与盐酸反应得到AlCl3与水,符合转化,C项正确;
D. 氯气与氢气反应得到HCl,浓HCl与高锰酸钾反应得到氯气,HCl与CuO反应得到CuCl2和水,CuCl2电解得到Cu与氯气,符合转化,D项正确;
答案选B。

【题目】A、B、C、D、E、F六种元素原子序数依次增大,前四种为短周期元素,E、F位于第四周期。已知A是自然界中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738 kJ·mol1、1451 kJ·mol1、7733 kJ·mol1;D在同周期元素中(除稀有气体元素外)第一电离能最大;E元素为金属元素,常用于合成催化剂,其基态原子的价电子数为7;F元素的某种高价盐可用作城市饮用水的净水剂,比D的单质用于净水更安全环保,F基态原子的3d能级上有6个电子。
(1)试写出下列四种元素的元素符号:A_____;B_____;E_____;F_________。
(2)写出A、B两种元素组成的所有化合物的化学式:_____________。
(3)写出电解CD2的化学方程式:_____。
(4)E、F均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | E | F | |
电离能/ kJ·mol1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
E元素位于第ⅦB族,请画出基态E2+的价电子排布图:_____,F元素在周期表中的位置是_____。比较两元素的I2、I3可知,气态基态E2+再失去1个电子比气态基态F2+再失去1个电子更难,对此你的解释是:_____。
【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。

(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。

其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。