��Ŀ����
����Ŀ��A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�ء���֪��A��Dͬ���壬AԪ�ص�ԭ�Ӱ뾶�����ڱ�����С��BԪ����������������֮��Ϊ2��C��EԪ��ԭ�ӵ������������������ڲ��������3�����ش��������⣺
��1��E��Ԫ�����ڱ��е�λ��Ϊ_________��B���ʵĵ���ʽΪ_________����Ԫ�ط��ű�ʾ����
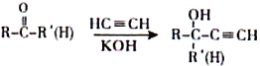
��2��Ԫ��A��C���γ�A2C2�ͻ�����û������д��ڵĻ�ѧ��Ϊ_________������ĸ����
a���������Ӽ�b�����й��ۼ�c���������Ӽ����й��ۼ�
��3��������M��N����A��C��D��E����Ԫ�ع��ɣ���������Һ�����Ӧ�����ӷ���ʽ��_________����4��B����̬�⻯�K������ˮ��ԭ����_________��
���𰸡���3������A�� ![]() b H++HSO3��=H2O+SO2�� NH3��H2O����֮���ܹ��γ����
b H++HSO3��=H2O+SO2�� NH3��H2O����֮���ܹ��γ����
��������
AԪ�ص�ԭ�Ӱ뾶�����ڱ�����С��A��HԪ�أ�A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�أ�A��Dͬ���壬D��NaԪ�أ�BԪ����������������֮��Ϊ2��B��NԪ�أ�C��EԪ��ԭ�ӵ������������������ڲ��������3����C��OԪ�ء�E��SԪ�ء�
��1��E��SԪ�أ���Ԫ�����ڱ��е�λ��Ϊ��3������A�壻B��NԪ�أ��䵥��N2�ĵ���ʽΪ![]() ��
��
��2��Ԫ��H��O�γ�A2C2�ͻ�������H2O2���û�����Ľṹ��H-O-O-H�����ڵĻ�ѧ��Ϊ���ۼ���ѡb��
��3��������M��N����H��O��Na��S����Ԫ�ع��ɣ����Ƿֱ���NaHSO4��NaHSO3������Һ�����Ӧ�����ӷ���ʽ��H++HSO3��=H2O+SO2����
��4��NԪ�ص���̬�⻯����NH3��NH3��H2O����֮���ܹ��γ����������NH3��������ˮ��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣���ش��й����⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1�����л�ѧ��������õ�Ԫ����______������Ԫ�ط��ű�ʾ��
��2���ڢۢ�����Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳����______����Ԫ�ط��ű�ʾ��
��3���õ���ʽ��ʾ������γɻ�����Ĺ���_______________________��
��4���ڢ١���Ԫ���У�Ԫ�ص�����������Ӧ��ˮ�����м�����ǿ��___�����ѧʽ��
��5���ڢ����ĵ����У���ѧ���ʽϻ��õ���_____�����ѧʽ��