题目内容
在给定条件下,可以大量共存的离子组是
- A.含有0.1 mol?L-1 Fe3+的溶液中:H+、Fe2+、Na+、Br-
- B.强碱性溶液中:K+、Al3+、Cl-、SO42-
- C.在pH=1的溶液中:Mg2+、Na+、ClO-、NO3-
- D.加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl-
AD
分析:A.含有0.1 mol?L-1 Fe3+的溶液具有氧化性,与Fe3+反应的离子不能大量共存;
B.强碱性溶液中存在大量的OH-离子;
C.pH=1的溶液呈酸性,与H+反应的离子不能大量共存;
D.加入强碱再加热,既有气体放出又有沉淀生成,题中离子符合,且可大量共存.
解答:A.含有0.1 mol?L-1 Fe3+的溶液中,离子之间不发生任何反应,可大量共存,故A正确;
B.强碱性溶液中存在大量的OH-离子,Al3+不能大量共存,故B错误;
C.pH=1的溶液呈酸性,ClO-与H+反应生成弱电解质而不能大量共存,故C错误;
D.加入强碱再加热,Ca2+、HCO3-、NH4+反应生成氨气和碳酸钙沉淀,且离子之间不发生任何反应,可大量共存,故D正确.
故选AD.
点评:本题考查离子共存问题,题目难度中等,注意把握题给信息,明确离子的种类和性质为解答该题的关键,易错点为D,注意加入强碱反应的特点.
分析:A.含有0.1 mol?L-1 Fe3+的溶液具有氧化性,与Fe3+反应的离子不能大量共存;
B.强碱性溶液中存在大量的OH-离子;
C.pH=1的溶液呈酸性,与H+反应的离子不能大量共存;
D.加入强碱再加热,既有气体放出又有沉淀生成,题中离子符合,且可大量共存.
解答:A.含有0.1 mol?L-1 Fe3+的溶液中,离子之间不发生任何反应,可大量共存,故A正确;
B.强碱性溶液中存在大量的OH-离子,Al3+不能大量共存,故B错误;
C.pH=1的溶液呈酸性,ClO-与H+反应生成弱电解质而不能大量共存,故C错误;
D.加入强碱再加热,Ca2+、HCO3-、NH4+反应生成氨气和碳酸钙沉淀,且离子之间不发生任何反应,可大量共存,故D正确.
故选AD.
点评:本题考查离子共存问题,题目难度中等,注意把握题给信息,明确离子的种类和性质为解答该题的关键,易错点为D,注意加入强碱反应的特点.

练习册系列答案
相关题目
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
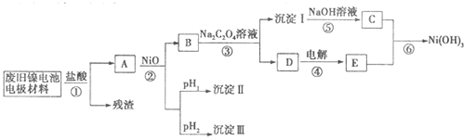
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Kap及沉淀析出的理论pH如下表所示:
| M(OH)n | Kap | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ______和沉淀Ⅲ______(填化学式),则pH1______ pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用______.
A.pH试纸B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则③的化学方程式是______.第③步反应后,过滤沉淀时需要的玻璃仪器有______.若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因______、______.
(3)④中阳极反应产生的气体E为______,验证该气体的试剂为______.
(4)试写出⑥的离子方程式______.
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是



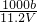
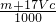
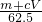
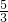 )m<p<(
)m<p<(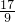 )m
)m 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰.H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和部分反应条件未列出)