题目内容
某温度下,在一个体积固定的密闭容器中,充入2molNO和1molO2,发生反应:2NO(g)+O2(g) 2NO2(g),一定条件下达到平衡,测得NO的转化率为80%(容器内温度不变),此时容器内压强与起始时压强之比为 ( )


| A.11∶15 | B.小于11∶15 | C.5∶6 | D.大于5∶6 |
B
首先进行化学平衡计算:
2NO(g) + O2(g) 2NO2(g)
2NO2(g)
n(起始)/mol 2 1 0
n(转化)/mol 1.6 0.8 1.6
n(平衡)/mol 0.4 0.2 1.6
则达平衡时,容器内压强与起始压强之比为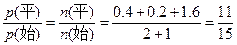 ,如果根据计算结果选A,就会大错特错,因为在密闭条件下,存在另一平衡关系:2NO2(g)
,如果根据计算结果选A,就会大错特错,因为在密闭条件下,存在另一平衡关系:2NO2(g) 2N2O4(g),因此只能小于11∶15,故选B。
2N2O4(g),因此只能小于11∶15,故选B。
2NO(g) + O2(g)
 2NO2(g)
2NO2(g)n(起始)/mol 2 1 0
n(转化)/mol 1.6 0.8 1.6
n(平衡)/mol 0.4 0.2 1.6
则达平衡时,容器内压强与起始压强之比为
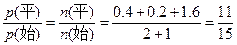 ,如果根据计算结果选A,就会大错特错,因为在密闭条件下,存在另一平衡关系:2NO2(g)
,如果根据计算结果选A,就会大错特错,因为在密闭条件下,存在另一平衡关系:2NO2(g) 2N2O4(g),因此只能小于11∶15,故选B。
2N2O4(g),因此只能小于11∶15,故选B。
练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
 2C(g)(正反应放热)
2C(g)(正反应放热) 2SO3( g );△H =" -197" kJ · mol-1,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
2SO3( g );△H =" -197" kJ · mol-1,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( ) xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
 2AB(g) 在一定条件下,达到平衡状态的标志是( )
2AB(g) 在一定条件下,达到平衡状态的标志是( ) FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。