题目内容
1.92gCu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则:
(1)反应中消耗HNO3 mol,转移电子 mol
(2)用排水法收集生成的气体,最后气体的体积为 L (标准状况)
(3)向收集到的气体中通入 mL O2(标准状况)才能使水刚好充满整个集气容器。
⑴0.11 0.06 ⑵0.448 ⑶336
解析试题分析:(1)根据题意知,1.92gCu片与一定量的浓HNO3作用生成硝酸铜、水、NO2和NO。根据铜原子守恒有:n[Cu(NO3)2]= n(Cu),根据氮原子守恒有:n(HNO3)=2n[Cu(NO3)2]+n(NO2+NO),则n(HNO3)=1.92g/64g·mol—1+0.05mol=0.11mol;ne=2nCu=1.92g/64g·mol—1×2=0.06mol;(2)根据题意知,n(NO)+n(NO2)=0.05mol,根据电子守恒有3n(NO)+n(NO2)=0.06mol,解得n(NO)=0.005mol,n(NO2)=0.045mol,利用排水法收集气体,发生的反应为3NO2+H2O====2HNO3+NO,收集的NO共0.02mol,标准状况下的体积为0.448L;(3)根据题意知,发生的反应为4NO+3O2+2H2O====4HNO3,n(NO) =0.02mol,则n(O2) =0.015mol,标准状况下的体积为336mL。
考点:考查硝酸、一氧化氮、二氧化氮的性质,根据化学方程式计算。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
| A.NaN3中只含有离子键 |
| B.1molNaN3完全分解最多可以产生33.6LN2 |
| C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂 |
| D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
(17分)Na2SO3固体在空气中久置容易变质 。
(I)Na2SO3固体在空气中变质的主要原因,用化学方程式表示为 。
(II)为探究Na2SO3样品的变质情况,现提出以下假设:
假设1:Na2SO3样品完全变质; 假设2:Na2SO3样品完全没有变质;假设3: 。
补充完成以下实验过程及现象和结论,完成探究。
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 离子,假设1不成立。 ②褪色的离子方程式为: 。 |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 ; 结论:假设2成立。 |
| …… | …… |
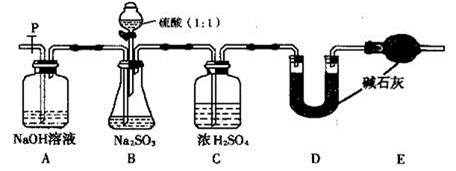
检查B装置气密性的操作为 。
(2)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(3)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处(填图中字母)装置实验前后的质量差。
现有四个无标签的试剂瓶,分别盛有硫酸、BaCl2溶液、盐酸和不知名称的某正盐溶液M,将四种试剂分别标为A、B、C、D,取少量试剂分别进行实验得到如表格所示关系(其中无色气体能使澄清石灰水变浑浊,M溶液进行焰色反应为黄色)。
| | A | B | C | D |
| A | | 白色沉淀X | | 白色沉淀Y |
| B | 白色沉淀X | | | 无色气体 |
(1)写出试剂名称:A ,B 。
(2)写出生成X的离子方程式: 。
(3)有人认为M是Na2CO3,此结论是否正确 (填“正确”或“不正确”),如认为正确,请说明推断的依据 ,如不正确,请说明理由 。
(4)若A、硝酸、D三种溶液混合后仍有沉淀,则其反应的离子方程式为 。


 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。


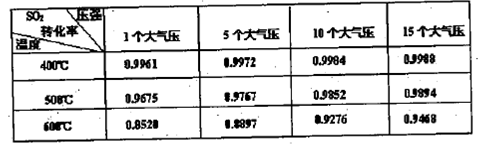
 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式