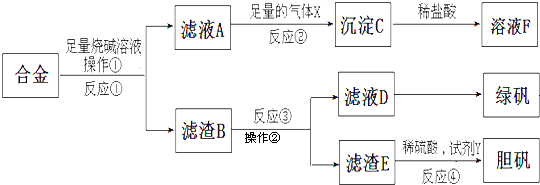
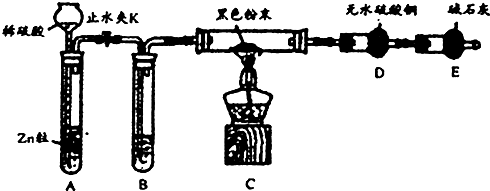
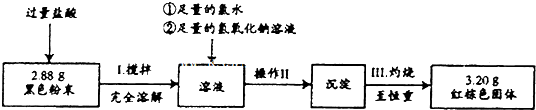
题目内容
3.正确书写下列离子反应的离子方程式.(1)锌与稀硫酸反应Zn+2H+═Zn2++H2↑;
(2)Na2CO3溶液加入BaCl2溶液CO32-+Ba2+═BaCO3↓;
(3)碳酸氢钠与盐酸反应HCO3-+H+=CO2↑+H2O;
(4)CuSO4溶液加入Ba(OH)2溶液Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓;
(5)CO2通入澄清石灰水使其变浑浊CO2+Ca2++2OH-═CaCO3↓+H2O.
分析 (1)锌与稀硫酸反应生成硫酸锌和氢气;
(2)Na2CO3溶液加入BaCl2溶液生成碳酸钡沉淀;
(3)碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水;
(4)CuSO4溶液加入Ba(OH)2溶液生成氢氧化铜和硫酸钡沉淀;
(5)CO2通入澄清石灰水反应生成碳酸钡沉淀和水.
解答 解:(1)锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为Zn+2H+═Zn2++H2↑,故答案为:Zn+2H+═Zn2++H2↑;
(2)Na2CO3溶液加入BaCl2溶液生成碳酸钡沉淀,反应的离子方程式为CO32-+Ba2+═BaCO3↓,故答案为:CO32-+Ba2+═BaCO3↓;
(3)碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,反应的离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O;
(4)CuSO4溶液加入Ba(OH)2溶液生成氢氧化铜和硫酸钡沉淀,反应的离子方程式为Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,
故答案为:Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓;
(5)CO2通入澄清石灰水反应生成碳酸钡沉淀和水,反应的离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O,故答案为:CO2+Ca2++2OH-═CaCO3↓+H2O.
点评 本题考查了离子方程式的书写,为高考高频点,熟悉离子方程式书写规则及其反应实质是解本题关键,注意(5)中氢氧化钙的书写,如果是澄清石灰水作反应物写离子,如果是石灰乳写化学式,为易错点.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
13.将大小相同、质量相等的镁条放入下列溶液中,反应速率按由大到小顺序排列正确的是 已知:醋酸的K a=1.8×10-5,亚硫酸的K a1=1.54×10-2.( )
①2mol/L H2SO3 ②2mol/L HAc
③2mol/L的HAc中加入少量的NaAc固体 ④2mol/L的盐酸.
①2mol/L H2SO3 ②2mol/L HAc
③2mol/L的HAc中加入少量的NaAc固体 ④2mol/L的盐酸.
| A. | ①③②④ | B. | ④①②③ | C. | ④①③② | D. | ①④③② |
18.米易龙潭溶洞景区被誉为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2-就是一种空气负离子,其摩尔质量为( )
| A. | 32 g | B. | 33 g/mol | C. | 33 g | D. | 32 g/mol |
12.下列反应最终能生成Fe3+的化合物的是( )
①Fe与过量的盐酸反应;②铁丝在硫蒸汽中燃烧;③向FeBr2溶液中通入少量的Cl2;
④铁与CuCl2溶液反应;⑤将Fe(OH)2露置于空气中.
①Fe与过量的盐酸反应;②铁丝在硫蒸汽中燃烧;③向FeBr2溶液中通入少量的Cl2;
④铁与CuCl2溶液反应;⑤将Fe(OH)2露置于空气中.
| A. | ①②③ | B. | ①③⑤ | C. | ③④ | D. | ③⑤ |
13.已知:C(s)+O2(g)═CO2(g);△H1
C(s)+CO2(g)═2CO(g);△H2
2CO(g)+O2(g)═2CO2(g);△H3
4Fe(s)+3O2(g)═2Fe2O3(s);△H4
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g);△H5
下列关于上述反应焓变的判断正确的是( )
C(s)+CO2(g)═2CO(g);△H2
2CO(g)+O2(g)═2CO2(g);△H3
4Fe(s)+3O2(g)═2Fe2O3(s);△H4
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g);△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H5<0 | B. | △H2>0,△H4>0 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
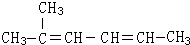 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.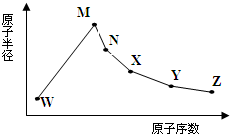 W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.
W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.